
第21屆聯合國氣候大會于2015年11月30日在巴黎召開,會議的主題是減少溫室氣體排放量。
Ⅰ.CO2 加氫合成甲醇是合理利用 CO2 的有效途徑。由 CO2 制備甲醇過程可能涉及反應如下:
反應①:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反應②:CO2(g)+H2(g)  CO (g)+H2O(g)△H2
CO (g)+H2O(g)△H2
反應③:CO(g)+2H2(g)  CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列問題:
CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列問題:
(1)反應②的△H2= ,反應 ① 自發進行條件是 (填“較低溫”、“較高溫”或“任何溫度”)。
(2)某溫度下,在體積為2 L的恒容密閉容器中,按如下方式加入反應物,僅發生反應①。一段時間后達到平衡。
容器 | 甲 | 乙 |
反應物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
測得甲中CO2和CH3OH(g)的濃度隨時間變化如圖所示。
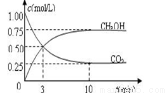
①前3min內,平均反應速率v(H2)= mol·L-1·min-1。此溫度下該反應的平衡常數為
(結果保留兩位小數) 。
②下列措施中,既能使反應速率加快,又能使n(CH3OH)/n(CO2)增大是 。
A.升高溫度 B.充入惰性氣體
C.將H2O(g)從體系中分離 D.再充入1mol H2
E.再充入1 mol CO2 F.加入催化劑
③反應達到平衡后,若向反應體系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化學平衡
(填“正向”、“逆向”或“不”)移動。
④要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則c的取值范圍為 。
Ⅱ.工業上可用CO2與NH3合成制尿素的原料氨基甲酸銨(H2NCOONH4)。氨基甲酸銨極易發生:H2NCOONH4+2H2O  NH4HCO3+NH3·H2O,該反應酸性條件下更徹底。25℃,向l L 0.1 mol·L-1的鹽酸中逐漸加入氨基甲酸銨粉末至溶液呈中性(忽略溶液體積變化),共用去0.052 mol氨基甲酸銨。若此時溶液中幾乎不含碳元素,則該溶液中 c(NH4+)=____________,NH4+水解常數Kh=________。
NH4HCO3+NH3·H2O,該反應酸性條件下更徹底。25℃,向l L 0.1 mol·L-1的鹽酸中逐漸加入氨基甲酸銨粉末至溶液呈中性(忽略溶液體積變化),共用去0.052 mol氨基甲酸銨。若此時溶液中幾乎不含碳元素,則該溶液中 c(NH4+)=____________,NH4+水解常數Kh=________。
科目:高中化學 來源:2015-2016學年河北省、永年二中高一下學期期中化學試卷(解析版) 題型:選擇題
下列判斷錯誤的是( )
A.沸點:NH3>PH3>AsH3
B.熔點:SiO2>NaCl>CH4
C.酸性:HClO4>H2SO4>H3PO4
D.堿性:NaOH>Mg(OH) 2>Al(OH)3
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽黃山屯溪一中高二下期中文科化學試卷(解析版) 題型:選擇題
下列關于食品添加劑的說法不正確的是
A.亞硝酸鈉可以致癌
B.我們應該禁止使用防腐劑
C.苯甲酸鈉可用作防腐劑
D.絕大多數食品添加劑在過量使用時對人體有害的
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三第三次模擬理綜化學試卷(解析版) 題型:填空題
某種鋰離子電池的正極材料是將含有鈷酸鋰(LiCoO2)的正極粉均勻涂覆在鋁箔上制成的,可以再生利用。某校研究小組嘗試回收廢舊正極材料中的鈷。
(1)25℃時,用圖1所示裝置進行電解,有一定量的鈷以Co2+的形式從正極粉中浸出,且兩極均有氣泡產生,一段時間后正極粉與鋁箔剝離。
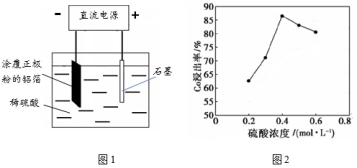
①陰極的電極反應式為:LiCoO2+4H++e-=Li++Co2++2H2O、 。
陽極的電極反應式為 。
②該研究小組發現硫酸濃度對鈷的浸出率有較大影響,一定條件下,測得其變化曲線如圖2所示。當c(H2SO4)>0.4mol/L時,鈷的浸出率下降,其原因可能為
。
(2)電解完成后得到含Co2+的浸出液,且有少量正極粉沉積在電解槽底部。用以下步驟繼續回收鈷。

①寫出“酸浸”過程中正極粉發生反應的化學方程式: 。該步驟一般在80℃以下進行,溫度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列關系中正確的是 (填字母序號)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4 )]
(3)已知所用鋰離子電池的正極材料為x g,其中LiCoO2 的質量分數為a%,則回收后得到CoC2O4·2H2O 的質量不高于 g。
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三第三次模擬理綜化學試卷(解析版) 題型:選擇題
下列敘述正確的是( )
A.測定相同溫度下鹽酸和醋酸溶液的pH,可證明鹽酸是強酸、醋酸是弱酸
B.改變溫度能改變任何可逆反應的平衡狀態
C.離子反應的結果是自由移動的離子濃度減小
D.Fe(OH)3膠體和飽和FeCl3溶液都呈紅褐色,可通過丁達爾效應區分二
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三考前訓練一理綜化學試卷(解析版) 題型:選擇題
乙烯催化氧化成乙醛可設計成如下圖所示的燃料電池,能在制備乙醛的同時獲得電能,其總反應為:2CH2 =CH2 + O2 → 2CH3CHO。下列有關說法正確的是( )
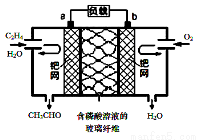
A.a電極發生還原反應
B.放電時,每轉移2mol電子,理論上需要消耗28g乙烯
C.b極反應式為:O2+4e-+2H2O=4OH-
D.電子移動方向:電極a→磷酸溶液→電極b
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二下期中化學試卷(解析版) 題型:選擇題
烯烴或炔烴在酸性高錳酸鉀溶液作用下,分子中的不飽和鍵完全斷裂,此法可用于減短碳鏈或利用產物反推不飽和烴的結構等。已知烯烴與酸性 KMnO4溶液反應的氧化產物的對應關系為
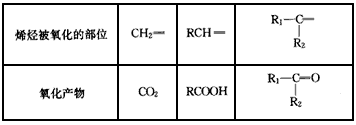
現有某烯烴與酸性KMnO4溶液作用后得到的氧化產物有CO2、乙二酸(HOOC-COOH)和丙酮 (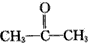 ),則該烯烴結構簡式可能是
),則該烯烴結構簡式可能是
A.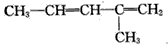
B.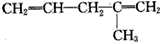
C. CH2=CH-CH=CHCH2CH3
D.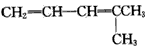
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省等四校高三聯考化學試卷(解析版) 題型:填空題
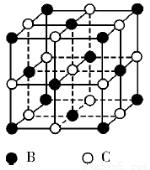
【選修3 :物質結構與性質】有A、B、C、D、E五種原子序數依次增大的元素(原子序數均不大于30)。A的基態原子2p能級有3個單電子;C的核外沒有成單電子,B、C兩元素形成的化合物晶胞結構如下圖所示;D的3p能級有1個單電子,且與B所在主族相鄰;E元素在地殼中含量居第四位;則:
(1)寫出基態E原子的價電子排布式 。
(2)A的最簡單氫化物分子的空間構型為 ,其中A原子的雜化類型是 。
(3)B能形成兩種常見的單質,其分子式分別為 ,其沸點是同族元素氫化物中最高的因是 。
(4)A和D形成的化合物中,D顯正化合價,試寫出該化合物與水反應的方程式: 。
(5)B、C兩元素形成的化合物晶胞結構中,B原子是堆積_______(填堆積模型);已知B和C形成的化合物晶體的密度為ρg • cm-3,阿伏加德羅常數為 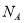 ,求晶胞邊長a = cm。(用含
,求晶胞邊長a = cm。(用含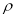 、
、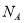 的計算式表示)
的計算式表示)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津市高一下期中化學試卷(解析版) 題型:選擇題
元素在周期表中的位置反映了元素的原子結構和元素的性質,下列說法正確的是
A.第一主族的元素稱為堿金屬
B.第二周期元素的最高化合價依次遞增,并等于它所處的主族序數
C.短周期元素形成離子后,最外層電子都達到8電子穩定結構
D.同一主族的元素的原子,最外層電子數一定相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com