
【題目】工業上用重晶石(主要成分為BaSO4)制備BaCO3的常用方法有高溫煅燒還原法、沉淀轉化法等。高溫煅燒還原法的工藝流程可簡單表示如下:
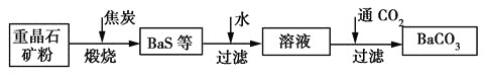
(1)若“煅燒”時產生一種有毒的還原性氣體,則反應的化學方程式為_____________。
(2)工業上煅燒重晶石礦粉時,為使BaSO4得到充分的還原和維持反應所需的高溫,應采取的措施是________。
a 加入過量的焦炭,同時通入空氣
b 設法將生成的BaS及時移出
(3)在第一次過濾后洗滌,檢驗是否洗滌干凈的試劑最好是________。
(4)沉淀轉化法制備BaCO3可用飽和Na2CO3溶液將BaSO4轉化為BaCO3:
BaSO4(s)+![]() (aq)BaCO3(s)+
(aq)BaCO3(s)+![]() (aq)
(aq)
①在實驗室將少量BaSO4固體全部轉化為BaCO3的實驗操作方法與步驟為_________。
②與高溫煅燒還原法相比,沉淀轉化法的優點主要有_______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。現欲用沉淀轉化法將BaSO4轉化為BaCO3,該反應的平衡常數為________。
【答案】BaSO4+4C![]() BaS+4CO↑ a H2SO4 將適量飽和Na2CO3溶液加入BaSO4固體中,充分攪拌,靜置,棄去上層清液;如此操作,反復多次(直到BaSO4全部轉化為BaCO3) 節能、環保(答案合理即可) 5×10-2
BaS+4CO↑ a H2SO4 將適量飽和Na2CO3溶液加入BaSO4固體中,充分攪拌,靜置,棄去上層清液;如此操作,反復多次(直到BaSO4全部轉化為BaCO3) 節能、環保(答案合理即可) 5×10-2
【解析】
(1)、BaSO4和C反應生成BaS和CO;
(2)a、加入過量的炭使BaSO4得到充分的還原,同時通入空氣使CO燃燒提供熱量;
B、設法將生成的BaS及時移出不能維持及應所需的高溫;
(3)、 BaS為可溶性鹽,檢驗是否洗滌干凈即檢驗是否含有鋇離子;
(4)①、難溶電解質的溶解平衡中,溶度積小的電解質也能向溶度積大的電解質轉化,注意濃度的大小問題;
②、根據所發生的化學反應來判斷分析方法的優點;
③、將BaSO4轉化為BaCO3:BaSO4+ CO32-= BaCO3 +SO42- ,根據反應的平衡常數計算。
(1) 、BaSO4和C反應生成BaS和CO,BaSO4+4C![]() BaS+4CO↑,故答案為: BaSO4+4C
BaS+4CO↑,故答案為: BaSO4+4C![]() BaS+4CO↑;
BaS+4CO↑;
(2) a、.加入過量的炭使BaSO4得到充分的還原,同時通入空氣使CO燃燒提供熱量,故a正確;
b、設法將生成的BaS及時移出不能維持及應所需的高溫,故b錯誤;
故選a;
(3)、 BaS為可溶性鹽,檢驗是否洗滌干凈即檢驗是否含有鋇離子,可用硫酸來檢驗,
故答案為:硫酸;
(4)①、常溫下,向飽和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因飽和Na2CO3溶液中高濃CO32-轉化BaCO3,
故答案為:將適量飽和Na2CO3溶液加入BaSO4固體中,充分攪拌,靜置,棄去上層清液;如此操作,反復多次(直到BaSO4全部轉化為BaCO3);
②、用飽和Na2CO3溶液沉淀轉化法的優點是不需要消耗能量、不產生污染物,
故答案為:節能,環保;
③、將BaSO4轉化為BaCO3:BaSO4+ CO32-= BaCO3 +SO42- 反應的平衡常數為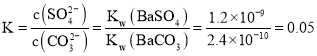 ,
,
故答案為0.05。


 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:
【題目】計算填空:
(1)______mol CO2中含有氧原子數跟1.806×1024個H2O分子含有的氧原子數相同。
(2)3.01×1023個H2O所含電子的物質的量為________mol。
(3)某同學將標準狀況下44.8L的HCl氣體溶于水,配成500mL的溶液,該HCl氣體的物質的量為______,可知所配成的鹽酸溶液的物質的量濃度為_____。
(4)標準狀況下的甲烷和一氧化碳的混合氣體8.96 L,其質量為7.60 g,則混合氣體中甲烷的體積為______;一氧化碳的質量為_________。
(5)氣態化合物A的化學式可以表示為OxFy,已知同溫同壓下10mLA受熱完全分解生成15mLO2和10mL F2,則A的化學式為_____。
(6)將5 mol·L-1的Mg(NO3)2溶液a mL稀釋至b mL,稀釋后溶液中NO![]() 的物質的量濃度是______ mol·L-1。
的物質的量濃度是______ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①R-NO2![]() R-NH2;②苯環上原有的取代基對新導入的取代基進入苯環的位置有顯著影響。以下是用苯作原料制備一系列化合物的轉化關系圖:
R-NH2;②苯環上原有的取代基對新導入的取代基進入苯環的位置有顯著影響。以下是用苯作原料制備一系列化合物的轉化關系圖:
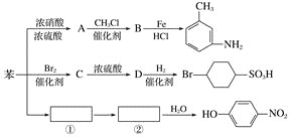
(1)A轉化為B的化學方程式是______________________________。
(2)圖中“苯→①→②”省略了反應條件,請寫出①②物質的結構簡式:①__________,②_______。
(3)苯的二氯代物有________種同分異構體。
(4)有機物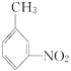 的所有原子________(填“是”或“不是”)在同一平面上。
的所有原子________(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素 X、Y、Z、W 原子序數依次增大,X 是地殼中含量最多的元素,Y 原子的最外層只有一個電子,Z 位于元素周期表ⅢA族,W 與X屬于同一主族。下列說法正確的是
A. 原子半徑:r(W) > r(Z) > r(Y)
B. 由X、Y 組成的化合物中均不含共價鍵
C. Y 的最高價氧化物的水化物的堿性比Z的弱
D. X 的簡單氣態氫化物的熱穩定性比W的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了證明稀硝酸與銅反應的氣體產物是NO,某同學設計了如下實驗裝置和實驗方案。
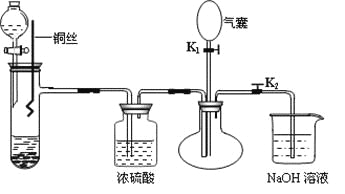
實驗步驟:
(1)關閉K1,打開K2,向試管中加石灰石,通過分液漏斗向其中加入一定的稀硝酸,則加入石灰石的作用是________________________________,反應化學方程式是_______________________。
(2)將將銅絲插入稀硝酸中,微熱大試管。該步反應離子方程式是________________________。
(3)充分反應后,打開開關K1,通過氣囊鼓入空氣,可以觀察到燒瓶中__________________,證明稀硝酸與銅反應的氣體產物是NO。
(4)NaOH溶液的作用__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D都是中學化學中常見的物質,其中A、B、C均含有同一種元素,在一定條件下相互轉化關系如下(部分反應中的水已略去)。根據題意回答下列問題:
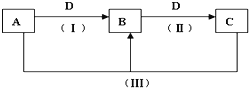
(1)若A、B、C的焰色反應均為黃色,A的水溶液能使酚酞溶液呈紅色,C為發酵粉的主要成分之一,D的過度排放會造成溫室效應。
①B的化學式為_____;
②反應Ⅲ的離子方程式是_______。
(2)寫出Na2O2做防毒面具時涉及到的化學反應的化學方程式:____________、__________。
(3)寫出Al(OH)3受熱分解的化學方程式:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向20mL含有1mol/L的氯化鋁溶液中逐滴加入濃度為1mol/L的氫氧化鈉溶液,產生沉淀的物質的量與所加堿的體積如圖所示:
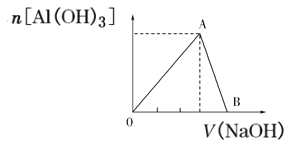
(1)寫出OA段和AB段發生反應的離子方程式:OA段_____;AB段_____。
(2)A點溶液中的溶質為:____。(填化學式)
(3)若產生0.78g白色沉淀,則加入的氫氧化鈉溶液的體積可能是____mL或____mL。
(4)B點表示的氫氧化鈉溶液的體積是___mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置。如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:

(1)氫氧燃料電池能量轉化的主要形式是____________________________________________,在導線中電子流動方向為________(用a、b表示)。
(2)負極反應式為________________________________________________________________。
(3)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反應Ⅰ中的還原劑是________,反應Ⅱ中的氧化劑是________。
②金屬鋰吸收的氫氣與放出的氫氣的物質的量之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于Na2CO3和NaHCO3的說法中,不正確的是
A. 焰色反應均為黃色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加熱的方法除去Na2CO3固體中的NaHCO3雜質
D. 物質的量相同的兩種固體分別與足量鹽酸反應,Na2CO3產生的二氧化碳多
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com