
下圖表示有關物質(均由短周期元素形成)之間的轉化關系,其中A為常見的金屬單質,B為非金屬單質(一般是黑色粉末),C是常見的無色無味液體,D是淡黃色的固體化合物。(反應條件圖中已省略。)
(1)A、B、C、D代表的物質分別為 、 、 、 (填化學式);
(2)反應①中的C、D均過量,該反應的化學方程式是 ; (3)反應②中,若B與F物質的量之比為4∶3,G、H分別是 、 (填化學式);
(3)反應②中,若B與F物質的量之比為4∶3,G、H分別是 、 (填化學式); (4)反應③產物中K的化學式為 ;
(4)反應③產物中K的化學式為 ; (5)反應④的離子方程式為 。
(5)反應④的離子方程式為 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
A、B、C、D四種物質都含有同種元素且有如圖所示轉化關系。試回答下列問題: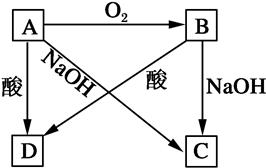
(1)若A是一種常見非金屬,且是一種半導體材料。寫出下列反應的方程式。
①B→D的化學方程式:__________________________________________________;
②A→C的離子方程式:__________________________________________________。
(2)若A是一種常見金屬,此時酸為強酸。寫出:A→D的離子方程式:__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中學化學常見物質A在一定條件下發生如下反應:A+B→E+F+H2O(未配平)
(1)若A為小蘇打,F為氣體。該反應的離子方程式為 。
(2)若A為紫紅色金屬單質,氣體F是由兩種位于同一主族的短周期元素組成。則E的化學式為________。
(3)若A是磁鐵礦的主要成分,B是鹽酸。寫出反應的化學方程式為 。
(4)若A為黃綠色氣體單質,F的堿性溶液吸收廢氣中SO2的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中學化學中常見的幾種物質存在下圖所示的轉化關系。其中,A是一種黑色粉末狀固體,C是一種黃綠色氣體,實驗室中常用E溶液吸收多余的C。(圖中部分產物和反應條件已略去)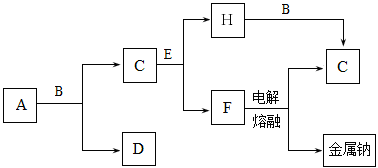
回答下列問題:
(1)寫出A與B的濃溶液反應的化學方程式 。
(2)固體E中含有化學鍵的類型是 ,C與E反應的離子方程式為 。
(3)將B的濃溶液與H的濃溶液混合,立即產生大量氣體C,該反應的離子方程式為 。
(4)某課外小組的同學用E溶液吸收C,利用下圖所示裝置向吸收液中持續通入SO2氣體。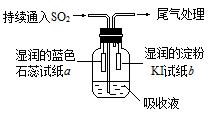
實驗過程中觀察到如下現象:
①開始時,溶液上方出現白霧,試紙a變紅。甲同學認為是HCl使a變紅,乙同學不同意甲的觀點,乙同學的認為使a變紅的是 (寫出一種即可)。
②片刻后,溶液上方出現黃綠色氣體,試紙b變藍。用離子方程式解釋b變藍的原因 。
③最終試紙b褪色。同學們認為可能的原因有兩種:一是I2有還原性,黃綠色氣體等物質將其氧化成
IO3-,從而使藍色消失;二是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中學常見反應的化學方程式是:A+B→X+Y+H2O(未配平,反應條件略去),其中,A、B的物質的量之比為1:4。請回答:
(1)若Y是黃綠色氣體,該反應的離子方程式是 。
(2)若A為常見的非金屬單質,B的溶液為某濃酸,其氧化產物的結構式為 ______
(3)若A為金屬單質,常溫下A在B的濃溶液中“鈍化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中兩種金屬陽離子的物質的量恰好相等,被還原的X
是 mol。
(4)若A、B、X、Y均為化合物。向A溶液中加入硝酸酸化的AgNO3溶液,產生白色沉淀;B的焰色為黃色。則A與B按物質的量之比1:4反應后,溶液中溶質的化學式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知常溫下B、D、E、L為密度比空氣大的氣體,D、E為單質,其他為化合物。A是一種淡黃色固體,C微溶于水,F、G均能與L的水溶液反應放出B。據下邊反應框圖填空。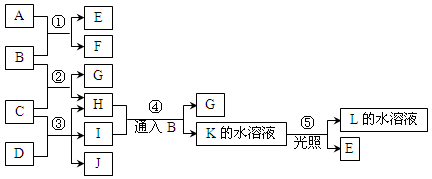
(1)F的俗名是 ,B分子的結構式為________工業上利用反應③生產 。
(2)反應④的離子方程式為 。
(3)有一種單質能與H反應生成E,該反應的化學方程式為 。
(4)某氣體M具有漂白作用,既有氧化性,又有還原性,M通入D的溶液中反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化合物A為一種常見金屬元素與一種常見非金屬元素組成的化合物,陽離子與陰離子的個數比為2:3。K為常見固態非金屬單質,J、N為常見氣態單質,其余為化合物,其中I、F在常溫下為液態,C、D為刺激性氣體,H無色無味氣體,B為白色膠狀沉淀,L為氯堿工業中的常見產品。F的濃溶液與K加熱可生成D和H。(部分生成物未標出)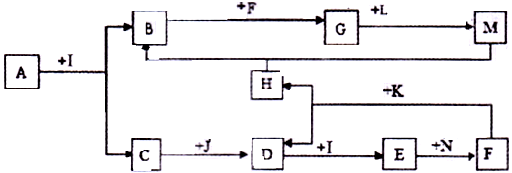
(1)H的結構式為: ;B的化學式為: 。
(2)寫出下列變化的化學方程式:
A+I →B+C: 。
F的濃溶液與K加熱可生成D和H: 。
(3)寫出下列變化的離子方程式:
N通入E的水溶液: 。
M的水溶液中通人過量的H: 。
(4)在A~K所有物質中屬于弱電解質的是_ ,屬于非電解質的是 (用編號回答)。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
中學化學中很多“規律”都有其適用范圍,下列根據有關“規律”推出的結論合理的是
| A.Na2O?Na2O2組成元素相同,推出與水反應產物也完全相同 |
| B.SO2和濕潤的Cl2都有漂白性,推出二者混合后漂白性更強 |
| C.H2CO3的酸性比HClO強,推出CO2通入NaClO溶液中能生成HClO |
| D.根據常溫下銅與濃硝酸反應可以制取NO2,推出常溫下鐵與濃硝酸反應也可以制取NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列反應中,反應后固體物質增重的是
| A.乙醇蒸汽通過灼熱的CuO粉末 | B.二氧化碳通過Na2O2粉末 |
| C.鋁與Fe2O3發生鋁熱反應 | D.將鋅粒投入Cu(NO3)2溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com