
【題目】下列過程或現象與鹽類水解無關的是
A.向Na2CO3溶液中滴加酚酞試液變紅色B.實驗室保存硫酸亞鐵溶液時加入少量鐵粉
C.加熱FeCl3溶液顏色會變深D.KAl(SO4)2·12 H2O可用于凈水
【答案】B
【解析】
A.Na2CO3+ H2O![]() NaOH+NaHCO3。水解產生了NaOH使溶液顯堿性,所以滴加酚酞試液變紅色,不符合題意,錯誤;
NaOH+NaHCO3。水解產生了NaOH使溶液顯堿性,所以滴加酚酞試液變紅色,不符合題意,錯誤;
B.硫酸亞鐵在空氣中容易被氧化為Fe3+,實驗室保存硫酸亞鐵溶液時加入少量鐵粉加入Fe粉是為了2Fe3++Fe=3Fe2+,為了防止硫酸亞鐵溶液變質。這與鹽的水解無關。符合題意,正確;
C.FeCl3是強酸弱堿鹽,鹽的水解反應是酸堿中和反應的逆反應,酸堿中和反應是放熱反應,所以鹽的水解反應是吸熱反應。升高溫度促進鹽的水解。所以加熱FeCl3溶液會使更多的Fe3+發生水解反應得到氫氧化鐵膠體,因此顏色會變深。不符合題意,錯誤;
D.KAl(SO4)2·12 H2O電離產生的Al3+發生水解反應:Al3++3H2O![]() Al(OH)3(膠體)+3H+.Al(OH)3膠體表面積大,吸附力強,能夠吸附水中的懸浮物使之變為沉淀除去,所以可用于凈水。不符合題意,錯誤。
Al(OH)3(膠體)+3H+.Al(OH)3膠體表面積大,吸附力強,能夠吸附水中的懸浮物使之變為沉淀除去,所以可用于凈水。不符合題意,錯誤。
答案選B。


科目:高中化學 來源: 題型:
【題目】對于反應2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反應歷程:
第一步:2N2O5 ![]() NO2 +NO3 快速平衡;
NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反應;
第三步:NO+ NO3 →2NO2 快反應;其中可近似認為第二步反應不影響第一步平衡。下列表述正確的是
A.υ逆(第一步) < υ正(第二步)B.反應的中間產物只有NO
C.第二步中NO2 和NO3 碰撞部分有效D.第三步正反應的活化能較高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以廢舊鉛酸電池中的含鉛廢料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4為原料,制備高純PbO,實現鉛的再生利用。其工作流程如圖:

(1)過程Ⅰ中,在Fe2+催化下,Pb和PbO2反應生成PbSO4的離子方程式是_________________。
(2)過程Ⅰ中,Fe2+催化過程可表示為:
ⅰ:2Fe2++PbO2+4H++SO![]() ===2Fe3++PbSO4+2H2O
===2Fe3++PbSO4+2H2O
ⅱ:……
①寫出ⅱ的離子方程式:_______________________________________。
②下列實驗方案可證實上述催化過程。將實驗方案補充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液幾乎無色,再加入少量PbO2,溶液變紅。
b._________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖1是銅鋅原電池示意圖。圖2中,x軸表示實驗時流入正極的電子的物質的量,y軸表示( )

A. 銅棒的質量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是![]()
A.鉛蓄電池放電時,負極質量減少,正極質量增加
B.為處理鍋爐水垢中的![]() ,可用飽和碳酸鈉溶液浸泡
,可用飽和碳酸鈉溶液浸泡
C.![]() 溶液中含HCN和
溶液中含HCN和![]() 總數目為
總數目為![]()
D.![]() 不能自發進行,加入合適的催化劑即可自發.
不能自發進行,加入合適的催化劑即可自發.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的定容密閉容器中,當下列物理量不再隨時間變化時,表明反A(s)+2B(g)![]() C(g)+D(g)一定達到平衡狀態的是
C(g)+D(g)一定達到平衡狀態的是
A.混合氣體的壓強B.混合氣體的密度
C.混合氣體的物質的量D.混合氣體中C和D的物質的量之比
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是![]()
A.在一瓣橘子上相隔![]() cm分別插上一小塊銅片和鋁片,把銅片和鋁片的另一端通過導線接觸耳機的兩極,能夠從耳機中聽到“嘎嘎”聲
cm分別插上一小塊銅片和鋁片,把銅片和鋁片的另一端通過導線接觸耳機的兩極,能夠從耳機中聽到“嘎嘎”聲
B.將兩朵紅色鮮花分別插入食用白醋和純堿稀溶液中![]() 每天更換上述稀溶液
每天更換上述稀溶液![]() ,幾天后花的顏色有明顯變化
,幾天后花的顏色有明顯變化
C.將適量的食醋加入內壁有水垢的水瓶中,緩慢轉動水瓶,一會兒水垢慢慢脫落
D.向25mL沸水中滴加![]() 滴稀的氯化鐵溶液制備氫氧化鐵膠體
滴稀的氯化鐵溶液制備氫氧化鐵膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二次硝酸(H2N2O2)是一種二元酸,可用于制N2O氣體。
(1)連二次硝酸中氮元素的化合價為_____________________。
(2)常溫下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,測得溶液pH與NaOH溶液體積的關系如圖所示。
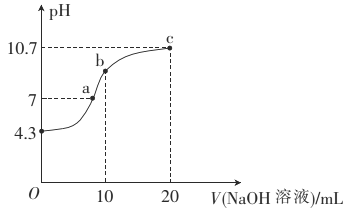
①寫出H2N2O2在水溶液中的電離方程式:______________。
②b點時溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a點時溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸銀溶液和連二次硝酸鈉溶液混合,可以得到黃色的連二次硝酸銀沉淀,向該分散系中滴加硫酸鈉溶液,當白色沉淀和黃色沉淀共存時,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加過程中溶液中-lgc(Cu2+)與Na2S溶液體積(V)的關系如圖所示,下列有關說法正確的是( )(已知:Ksp(ZnS)=3×10-25)

A.a、b、c三點中,水的電離程度最大的為b點
B.Na2S溶液呈堿性的原因: S2-+2H2O![]() H2S+ 2OH-
H2S+ 2OH-
C.a、b、c三點中, b點溶液中S2-度最小
D.向100 mL Zn2+、Cu2+濃度均為10-5mol·L-1的混合溶液中逐滴加入10-4 mol·L-1的Na2S溶液,Cu2+先沉淀
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com