
【題目】以煉鋅煙塵(主要成份為ZnO,含少量CuO和FeO)為原料,可以制取氯化鋅和金屬鋅。
Ⅰ、制取氯化鋅主要工藝如下:
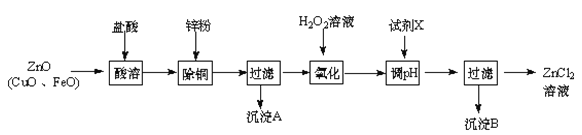
已知:Zn及化合物的性質與Al及化合物的性質相似,pH>11時Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0 mol·L-1計算)。

(1)加入H2O2溶液發生反應的離子方程式為 。
(2)流程圖中,為了降低溶液的酸度,試劑X可以是 (選填序號:a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3 ;d.ZnSO4);pH應調整到 。
(3)氯化鋅能催化乳酸(![]() )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的結構簡式為 ,聚乳酸的結構簡式為 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的結構簡式為 ,聚乳酸的結構簡式為 。
Ⅱ、制取金屬鋅采用堿溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后電解浸取液。
(4)以石墨作電極電解時,陽極產生的氣體為 ;陰極的電極反應為 。
(5)煉鋅煙塵采用堿溶,而不采用酸溶后電解,主要原因是 。
【答案】
(1)2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O
(2)abc ;3.2 ≤ pH<5.2(或:約為4)
(3)![]() ;
;![]() (或:
(或:![]() )
)
(4)O2 (或氧氣); [Zn(OH)4]2-+2e-=Zn+4OH-
(5)氧化銅、氧化亞鐵不溶于堿溶液中
【解析】
試題分析:煉鋅煙塵(主要成份為ZnO,含少量CuO和FeO)加鹽酸溶解,形成氯化鋅、氯化銅、氯化亞鐵的溶液,加鋅粉置換出Cu,過濾,濾液中含有鋅離子和亞鐵離子,加過氧化氫氧化,把亞鐵離子氧化為鐵離子,加ZnO(或氫氧化鋅等)調節PH,鐵離子轉化為氫氧化鐵沉淀,過濾除去沉淀,得到氯化鋅溶液。
(1)加過氧化氫將亞鐵離子氧化為鐵離子,反應的離子方程式為:2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O;(2)調節pH時要消耗氫離子,但是不能引入雜質,ZnO、Zn(OH)2、Zn2(OH)2CO3均與氫離子反應生成鋅離子,消耗氫離子的同時不引人雜質,ZnSO4不能與氫離子反應,所以不能調節pH,答案選abc;調節pH使鐵離子轉化為沉淀,而鋅離子不沉淀,由表中數據可知pH≥3.2時,鐵離子完全沉淀,而鋅離子開始沉淀的pH為5.2,所以要調節pH為3.2≤pH<5.2;
(3)![]() 分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應,反應產物為
分子中含有-COOH和-OH,兩分子的乳酸分子間發生酯化反應,反應產物為![]() ;
;![]() 分子間發生縮聚反應生成聚乳酸和水,聚乳酸的結構簡式為:
分子間發生縮聚反應生成聚乳酸和水,聚乳酸的結構簡式為:![]() ;
;
(4)石墨作電極電解時,陽極氫氧根離子失電子,陽極反應為:4OH--4e-═2H2O+O2↑,所以陽極產生的氣體是O2;陰極上[Zn(OH)4]2-得電子生成Zn,則陰極的電極方程式為:[Zn(OH)4]2-+2e-=Zn+4OH-。(5)ZnO能溶于強堿溶液,CuO和FeO不溶于堿溶液,酸溶液與ZnO、CuO、FeO均能反應,所以煉鋅煙塵采用堿溶,而不采用酸溶后電解。


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】下表為元素周期表中的一部分。用化學式或元素符號回答下列問題:
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10種元素中,化學性質最不活潑的是__________(填元素名稱)。
(2)三周期元素除⑩外原子半徑最小的是______(填元素符號),這些元素的最高價氧化物對應水化物中堿性最強的是__________(填化學式,下同),具有兩性的是____________。
(3)在室溫下有顏色的氣體單質溶于水的離子方程式為_____ __;
(4)⑧與⑨分別與H2形成的氫化物的穩定性:__________,(用化學式表示)最高價氧化物對應的水溶液的酸性由強到弱的順序:______ _________。(用化學式)
(5)①③⑤單質的活潑性順序為_____>____>____(填元素符號),判斷的實驗依據是__(寫出一種)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種前四周期的元素。A原子核外有1個未成對電子,A+比B原子少一個電子層,B原子得一個電子填入3p軌道后,3p軌道呈全充滿狀態。C原子的2p軌道有2個未成對電子,D的最高化合價和最低化合價的代數和為4,與C的核電荷數相差8。E位于周期表第12縱列且是六種元素中原子序數最大的。R是由D、E形成的化合物,其晶胞結構如圖所示。請回答下列問題:

(1)C元素的電負性___D元素的電負性(填“>”、“<”或“=”)。
(2)C的第一電離能比它同周期前一族相鄰元素的第一電離能________
(填“大”或“小”)。
(3)E的價電子排布式為_______ _,該元素位于周期表中__ _族。
(4)化合物A2D的電子式為______________________。
(5)D和B形成的一種化合物D2B2廣泛用于橡膠工業,它的分子結構與雙氧水相似,但在該化合物分子中,所有原子最外層均滿足8電子穩定結構。則D2B2分子中D原子的雜化類型是__________,D2B2是_________分子(填“極性”或“非極性”)。
(6)R的化學式為________________(用元素符號表示)。已知R晶體的密度為ρ g·cm-3,則該晶胞的邊長a=_____________ cm,(阿伏加德羅常數用NA表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】功能高分子P的合成路線如下:

(1)A的分子式是C7H8,其結構簡式是___________________。
(2)試劑a是_______________。① ③ ② ④ ⑤ ⑥ n
(3)反應③的化學方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能團:_______________。
(5)反應④的反應類型是_______________。
(6)反應⑤的化學方程式:_______________。
(5)已知: 。
。
以乙烯為起始原料,選用必要的無機試劑合成E,寫出合成路線(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,將3mol A和1mol B兩種氣體混合于固定容積為2L的密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g)+2D(g)。2min末該反應達到平衡,生成0.8mol D,并測得C的濃度為0.2mol·L-1。下列判斷錯誤的是( )
xC(g)+2D(g)。2min末該反應達到平衡,生成0.8mol D,并測得C的濃度為0.2mol·L-1。下列判斷錯誤的是( )
A.x=1
B.B的轉化率為80%
C.2min內A的平均反應速率為0.3 mol·(L·min)-1
D.若混合氣體的密度不變,也不能明該反應達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 CO分析儀以燃料電池為工作原理,用來測量汽車尾氣中的CO的含量,其裝置如圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質NASICON中自由移動。下列說法錯誤的是( )。

A.負極的電極反應式為:CO+O2—―2e-=CO2
B.工作時電極b作正極,O2-由電極a流向電極b
C.工作時電子由電極a通過傳感器流向電極b
D.傳感器中通過的電流越大,尾氣中CO的含量越高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.化學與科學、技術、社會、環境密切相關,下列做法中正確的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技術,不能降低機動車尾氣中有害氣體排放
B.工業上用石灰乳對煤燃燒后形成的煙氣進行脫硫,最終能制得石膏
C.為了有效的發展清潔能源,采用電解水的方法大量制備H2
D.世博停車場安裝催化光解設施,可將汽車尾氣中CO和NOx反應生成無毒氣體
II.浩瀚的海洋是一個巨大的資源寶庫,蘊藏著豐饒的礦產,是寶貴的化學資源,下圖是海水加工的示意圖,根據下圖回答問題。

(1)海水淡化工廠通常采用的制備淡水的方法有 (寫出兩種)。
(2)下圖是從濃縮海水中提取溴的流程圖。寫出下圖中①②的化學式:① ,② ,吸收塔中發生的化學反應方程式為 。

(3)制備金屬鎂是通過電解熔融的MgC12,而不用MgO,其原因是 。
(4)食鹽也是一種重要的化工原料,氯堿工業就是通過電解飽和食鹽水來制備NaOH、H2和C12。海水中得到的粗鹽中往往含有一些雜質,必須加入一些化學試劑,使雜質沉淀,處理后的鹽水還需進入陽離子交換塔,其原因是 。電解食鹽水在離子交換膜電解槽中進行,離子交換膜的作用是 。
(5)多晶硅主要采用SiHCl3還原工藝生產,其副產物SiCl4可轉化為SiHCl3而循環使用。一定條件下,在20L恒容密閉容器中的反應:3SiCl4(g)+2H2(g)+Si(g)![]() 4SiHCl3(g)。達平衡后,H2與SiHCl3物質的量濃度分別為0.140mol/L和0.020mol/L。若H2全部來源于氯堿工業,理論上需消耗純NaCl的質量為 kg。
4SiHCl3(g)。達平衡后,H2與SiHCl3物質的量濃度分別為0.140mol/L和0.020mol/L。若H2全部來源于氯堿工業,理論上需消耗純NaCl的質量為 kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是利用鹽橋電池從某些含碘鹽中提取碘的兩個裝置, 下列說法中正確的是
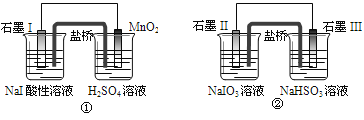
A.兩個裝置中石墨I和石墨II作負極
B.碘元素在裝置①中被氧化,在裝置②中被還原
C.①中MnO2的電極反應式為:MnO2+2H2O+2e-==Mn2++4OH
D.反應①、②中生成等量的I2時導線上通過的電子數之比為1∶5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D 4種短周期元素,它們的元素原子序數依次增大,由B、C、D形成的離子具有相同的電子層結構。B原子的最外層電子數是次外層的三倍,C、D單質都能跟水劇烈反應,1 mol D單質跟水反應產生11.2 L(標準狀況)A氣體,此時D轉化為具有氖原子核外電子層結構的離子。試填寫:
(1)用電子式表示A和C形成化合物的過程______________。
(2)C原子的結構示意圖_______________,寫出A、B兩元素按1:1原子個數比形成化合物的電子式_______________。
(3)這4種元素的原子半徑由大到小的順序為_______________。(用元素符號表示)
(4)寫出C單質與水反應的化學反應方程式__________________________;。
(5)寫出D單質與水反應的離子方程式__________________________,
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com