
【題目】下列事實不能證明HNO2是弱電解質的是( )
①滴入酚酞,NaNO2溶液顯紅色②用HNO2溶液做導電實驗,燈泡很暗
③等pH、等體積的鹽酸和HNO2溶液中和堿時,HNO2的中和堿能力強
④0.1molL-1HNO2溶液的pH=2⑤HNO2與CaCO3反應放出CO2氣體
⑥c(H+)=0.1molL-1的HNO3溶液稀釋至1000倍,pH<4
A.②⑤B.①⑤C.③⑥D.③④
【答案】A
【解析】
①滴入酚酞,NaNO2溶液顯紅色,證明NaNO2是強堿弱酸鹽,NO2-水解使溶液顯堿性:NO2- + H2O ![]() HNO2 + OH- ,證明HNO2是弱電解質,①不符合題意;
HNO2 + OH- ,證明HNO2是弱電解質,①不符合題意;
②用HNO2溶液做導電實驗,燈泡很暗,沒有說明濃度大小,不能證明HNO2是弱電解質,②符合題意;
③等pH、等體積的鹽酸和HNO2溶液中和堿時,HNO2的中和堿能力強,說明HNO2沒有完全電離,證明HNO2是弱電解質,③不符合題意;
④0.1molL-1HNO2溶液的pH=2,說明電離的HNO2濃度為0.01molL-1,沒有完全電離,證明HNO2是弱電解質,④不符合題意;
⑤HNO2與CaCO3反應放出CO2氣體,證明酸性HNO2>H2CO3,但不能證明HNO2是弱電解質,⑤符合題意;
⑥c(H+)=0.1molL-1的HNO3溶液稀釋至1000倍,pH<4,說明HNO2不是強酸,證明HNO2是弱電解質,⑥不符合題意;
總之,②⑤符合題意,A選項正確;
答案選A。


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:
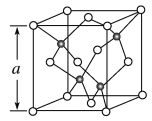
【題目】(1)Cu的一種氯化物晶胞結構如圖所示(黑球表示銅原子,白球表示氯原子),該氯化物的化學式是__。若該晶體的密度為ρg·cm-3,以NA表示阿伏加德羅常數的值,則該晶胞的邊長a=__nm。
(2)一種四方結構的超導化合物的晶胞如圖1所示,晶胞中Sm和As原子的投影位置如圖2所示。
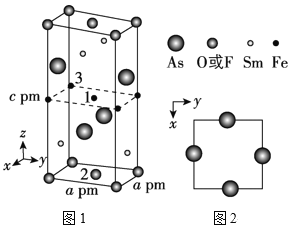
圖中F-和O2-共同占據晶胞的上下底面位置,若兩者的比例依次用x和1x代表,則該化合物的化學式表示為__,通過測定密度ρ和晶胞參數,可以計算該物質的x值,完成它們關系表達式:ρ=__g·cm-3。
以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標,例如圖1中原子1的坐標為(![]() ,
,![]() ,
,![]() ),則原子2和3的坐標分別為__、__。
),則原子2和3的坐標分別為__、__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:將![]() 溶液用
溶液用![]() 鹽酸滴定時,若用酚酞做指示劑,終點時消耗鹽酸
鹽酸滴定時,若用酚酞做指示劑,終點時消耗鹽酸![]() ;若用甲基橙做指示劑,終點時消耗鹽酸
;若用甲基橙做指示劑,終點時消耗鹽酸![]() 。現有一份白色粉末,可能含有
。現有一份白色粉末,可能含有![]() 、
、![]() 、
、![]() 的一種或兩種。現取一定量的該粉未配成適當濃度的稀溶液并分成兩等份,分別用
的一種或兩種。現取一定量的該粉未配成適當濃度的稀溶液并分成兩等份,分別用![]() 鹽酸滴定。一份用酚酞做指示劑,消耗鹽酸
鹽酸滴定。一份用酚酞做指示劑,消耗鹽酸![]() ;另一份用甲基橙做指示劑,消耗鹽酸
;另一份用甲基橙做指示劑,消耗鹽酸![]() 。下列說法正確的是( )
。下列說法正確的是( )
①若![]() ,則固體中只含有
,則固體中只含有![]()
②若![]() ,則固體中只含
,則固體中只含![]()
③若![]() ,則固體中含有
,則固體中含有![]() 、
、![]()
④若![]() ,則固體中含有
,則固體中含有![]() 、
、![]()
A.①②③④B.③④C.①②D.①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列反應可用于檢測司機是否酒后駕駛:![]()
![]() 。
。
①配合物![]() 中,與
中,與![]() 形成配位鍵的原子是__________(填元素符號)。
形成配位鍵的原子是__________(填元素符號)。
②![]() 中
中![]() 原子的雜化軌道類型是________;
原子的雜化軌道類型是________;![]()
![]() 含有
含有![]() 鍵的數目為_______。
鍵的數目為_______。
(2)![]() 分子中,
分子中,![]() 原子的雜化軌道類型是__________;寫出由3個原子組成且與
原子的雜化軌道類型是__________;寫出由3個原子組成且與![]() 具有相同空間構型的離子:___________(填一個即可)。
具有相同空間構型的離子:___________(填一個即可)。
(3)石墨烯(結構如圖1所示)是一種由單層碳原子構成的具有平面結構的新型碳材料,石墨烯中部分碳原子被氧化后,其平面結構會發生改變,轉化為氧化石墨烯(結構如圖2所示)。

氧化石墨烯中2號![]() 原子的雜化方式是_________,該
原子的雜化方式是_________,該![]() 原子與相鄰
原子與相鄰![]() 原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號
原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號![]() 與相鄰
與相鄰![]() 形成的鍵角。
形成的鍵角。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家最近成功合成了世界上首個五氮陰離子鹽![]() (用
(用![]() 代表)。回答下列問題:
代表)。回答下列問題:
(1)元素的基態氣態原子得到一個電子形成氣態負一價離子時所放出的能量稱作第一電子親和能(![]() )。第二周期部分元素的
)。第二周期部分元素的![]() 變化趨勢如圖(a)所示,其中除氮元素外,其他元素的
變化趨勢如圖(a)所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是__________;氮元素的
自左而右依次增大的原因是__________;氮元素的![]() 呈現異常的原因是_________。
呈現異常的原因是_________。
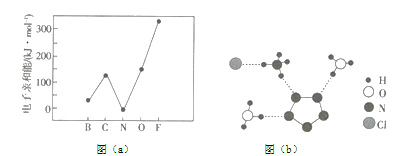
(2)經![]() 射線衍射測得化合物
射線衍射測得化合物![]() 的晶體結構,其局部結構如圖(b)所示。
的晶體結構,其局部結構如圖(b)所示。
①從結構角度分析,![]() 中兩種陽離子的相同之處為__________,不同之處為__________。(填標號)
中兩種陽離子的相同之處為__________,不同之處為__________。(填標號)
A 中心原子的雜化軌道類型 B 中心原子的價層電子對數
C 立體結構 D 共價鍵類型
②![]() 中陰離子
中陰離子![]() 中的鍵總數為__________個。分子中的大
中的鍵總數為__________個。分子中的大![]() 鍵可用符號表示
鍵可用符號表示![]() ,其中
,其中![]() 代表參與形成大
代表參與形成大![]() 鍵的原子數,
鍵的原子數,![]() 代表參與形成大
代表參與形成大![]() 鍵的電子數(如苯分子中的大
鍵的電子數(如苯分子中的大![]() 鍵可表示為
鍵可表示為![]() )則
)則![]() 中的大
中的大![]() 鍵應表示為__________。
鍵應表示為__________。
③圖(b)中虛線代表氫鍵,其表示式為![]() 、__________、__________。
、__________、__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A(g)+B(g)![]() C(g)+D(g)反應的平衡常數和溫度的關系如下:
C(g)+D(g)反應的平衡常數和溫度的關系如下:
溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列問題:
(1)該反應的平衡常數表達式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃時,向一個5L的密閉容器中充入0.20mol的A和0.80mol的B,如反應初始6s內A的平均反應速率v(A)=0.003molL-1s-1,則6s時c(A)=___molL-1,C的物質的量為___mol;若反應經一段時間后,達到平衡時A的轉化率為___,如果這時向該密閉容器中再充入1mol氬氣,平衡時A的轉化率為___。
(3)一定溫度下,能判斷該反應達化學平衡狀態的是___。
①單位時間內生成nmolA,同時消耗nmolC
②A的轉化率不變
③容器內壓強不再變化
④混合氣體的密度不再變化
⑤混合氣體的平均相對分子質量不再變化
(4)1200℃時,C(g)+D(g)![]() A(g)+B(g)的平衡常數的值為___。
A(g)+B(g)的平衡常數的值為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法或表示方法正確的是( )
A.等質量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多
B.氫氣的燃燒熱為285.8 kJ·mol-1,則氫氣燃燒的熱化學方程式為2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和熱為57.3 kJ·mol-1,若將含0.5 mol H2SO4的濃溶液與含1 mol NaOH的 稀溶液混合,則放出的熱量大于57.3 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧化鋰是制取鋰和鋰的化合物的原料,用電解法制備氫氧化鋰的工作原理如圖所示:
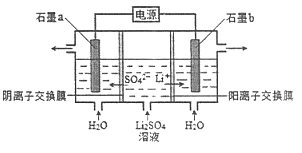
下列敘述不正確的是
A.b極附近溶液的pH增大
B.a極發生的反應為2H2O-4e-=O2↑+4H+
C.該法制備LiOH還可得到硫酸和氫氣等產品
D.b極是電解池的陽極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是現代工業的重要原料,將氯化氫轉化為氯氣的技術成為科學研究的熱車點,回答下列問題:
(1)Deacon發明的直接氧化法為:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化過程進行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反應Ⅰ能自發進行的條件是___。利用ΔH1和ΔH2計算ΔH3時,還需要利用反應___的ΔH。
(2)如圖為剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時HCl平衡轉化率隨溫度變化的關系:

可知反應平衡常數K(400℃)__K(500℃)(填“大于”或“小于”)。設容器內初始壓強為p0,根據進料濃度比c(HCl):c(O2)=4:1的數據,計算400℃時容器內的平衡壓強=___(列出計算式)。按化學計量比進料可以保持反應物高轉化率,同時降低產物分離的能耗。進料濃度比c(HCl):c(O2)過低、過高的不利影響分別是___。
(3)已知:氯氣與NaOH溶液反應可生成NaClO3。有研究表明,生成NaClO3的反應分兩步進行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常溫下,反應Ⅱ能快速進行,但氯氣與NaOH溶液反應很難得到NaClO3,試用碰撞理論解釋其原因:___。
(4)電解NaClO3水溶液可制備NaClO4,寫出陽極反應式:___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com