
【題目】SCR和NSR技術可有效降低柴油發動機在空氣過量條件下的NOx排放.
(1)SCR(選擇性催化還原)工作原理:
①尿素[CO(NH2)2]水溶液熱分解為NH3和CO2 , 該反應的化學方程式: .
②反應器中NH3還原NO2的化學方程式: .
③當燃油中含硫量較高時,尾氣中SO2在O2作用下會形成(NH4)2SO4 , 使催化劑中毒.用化學方程式表示(NH4)2SO4的形成: .
④尿素溶液濃度影響NO2的轉化,測定溶液中尿素(M=60gmol﹣1)含量的方法如下:取a g尿素溶液,將所含氮完全轉化為NH3 , 所得NH3用過量的v1 mL c1 molL﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 molL﹣1NaOH溶液恰好中和,則尿素溶液中溶質的質量分數是 .
(2)NSR(NOx儲存還原)工作原理:
NOx的儲存和還原在不同時段交替進行,如圖a所示.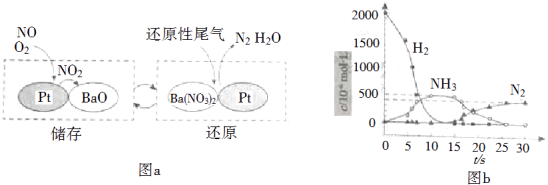
①通過BaO和Ba(NO3)2的相互轉化實驗NOx的儲存和還原.儲存NOx的物質是 .
②用H2模擬尾氣中還原性氣體研究了Ba(NO3)2的催化還原過程,該過程分兩步進行,圖b表示該過程相關物質濃度隨時間的變化關系.第一步反應消耗的H2與Ba(NO3)2的物質的量之比是 .
③還原過程中,有時會產生笑氣(N2O).用同位素示蹤法研究發現笑氣的產生與NO有關.在有氧條件下15NO與NH3以一定比例反應時,得到的笑氣幾乎都是15NNO.將該反應的化學方程式補充完整: .
【答案】
(1)CO(NH2)2+H2O ![]() 2NH3↑+CO2↑;8NH3+6NO2
2NH3↑+CO2↑;8NH3+6NO2 ![]() 7N2+12H2O;2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
7N2+12H2O;2SO2+O2+4NH3+2H2O═2(NH4)2SO4;![]()
(2)BaO;8:1;415NO+4NH3+3O2 ![]() 415NNO+6H2O
415NNO+6H2O
【解析】解:(1)①尿素[CO(NH2)2]水溶液熱分解為NH3和CO2 , 反應物為尿素和水,反應生成物為氨氣和水,原子守恒書寫化學方程式為:CO(NH2)2+H2O ![]() 2NH3↑+CO2↑,
2NH3↑+CO2↑,
故答案為:CO(NH2)2+H2O ![]() 2NH3↑+CO2↑;
2NH3↑+CO2↑;
②NH3在催化劑作用下還原NO2生成氮氣和水,反應的化學方程式為8NH3+6NO2 ![]() 7N2+12H2O,
7N2+12H2O,
故答案為:8NH3+6NO2 ![]() 7N2+12H2O;
7N2+12H2O;
③SO2在O2作用下與NH3、H2O反應形成(NH4)2SO4 , 此反應中SO2是還原劑,氧氣是氧化劑,反應的化學方程式為2SO2+O2+4NH3+2H2O═2(NH4)2SO4 ,
故答案為:2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
④涉及反應為2NH3+H2SO4=n(NH4)2SO4 , 2NaOH+H2SO4=Na2SO4+H2O,反應中n(H2SO4)=v1×c1×10﹣3mol,n(NaOH)=v2×c2×10﹣3mol,
由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),
則n(NH3)=(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol,
則m(CO(NH2)2)= ![]() ×(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol×60g/mol=(0.06v1c1﹣0.03v2c2 )g,尿素溶液中溶質的質量分數是
×(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol×60g/mol=(0.06v1c1﹣0.03v2c2 )g,尿素溶液中溶質的質量分數是 ![]() =
= ![]() ,
,
故答案為: ![]() ;(2)①由圖示可知BaO和NOx反應生成Ba(NO3)2 , Ba(NO3)2再還原為N2 , 則儲存NOx的物質為BaO,故答案為:BaO;
;(2)①由圖示可知BaO和NOx反應生成Ba(NO3)2 , Ba(NO3)2再還原為N2 , 則儲存NOx的物質為BaO,故答案為:BaO;
②第一步反應中H2被氧化生成水,化合價由0價升高到+1價,Ba(NO3)2的N元素化合價由+5價降低到﹣3價,生成氨氣,則1molBa(NO3)2生成氨氣轉移16mol電子,參加反應的氫氣的物質的量為 ![]() =8mol,則消耗的H2與Ba(NO3)2的物質的量之比是8:1,
=8mol,則消耗的H2與Ba(NO3)2的物質的量之比是8:1,
故答案為:8:1;③在有氧條件下15NO與NH3以一定比例反應時,得到的笑氣幾乎都是15NNO,由N元素守恒可知15NO與NH3應為1:1,可知反應的化學方程式為415NO+4NH3+3O2 ![]() 415NNO+6H2O,
415NNO+6H2O,
故答案為:415NO+4NH3+3O2 ![]() 415NNO+6H2O
415NNO+6H2O
(1)①尿素[CO(NH2)2]水溶液熱分解為NH3和CO2 , 結合原子守恒配平書寫化學方程式;
②反應器中NH3還原NO2生成氮氣和水,根據電子守恒和原子守恒可得此反應的化學方程式;
③SO2在O2作用下與NH3、H2O反應形成(NH4)2SO4 , 此反應中SO2是還原劑,氧氣是氧化劑,結合電子守恒和原子守恒可得此反應的化學方程式;
④涉及反應為2NH3+H2SO4=n(NH4)2SO4 , 2NaOH+H2SO4=Na2SO4+H2O,由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),以此計算;(2)①由圖a可知儲存NOx的物質是BaO;②第一步反應中H2被氧化生成水,化合價由0價升高到+1價,Ba(NO3)2的N元素化合價由+5價降低到﹣3價,生成氨氣,結合得失電子數目相等計算;③在有氧條件下15NO與NH3以一定比例反應時,得到的笑氣幾乎都是15NNO,由N元素守恒可知15NO與NH3應為1:1,結合電子得失相等配平.


科目:高中化學 來源: 題型:
【題目】哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎。
N2+3H2![]() 2NH3
2NH3
現向一密閉容器中充入1 mol N2和3 mol H2,在一定條件下使該反應發生,下列有關說法正確的是( )
A.達到化學平衡時,N2將完全轉化為NH3
B.達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等
C.達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化
D.達到化學平衡時,正反應和逆反應的速率都為零
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)綠礬是含有一定量結晶水的硫酸亞鐵,在工農業生產中具有重要的用途.某化學興趣小組對綠礬的一些性質進行探究.回答下列問題:
(1)在試管中加入少量綠礬樣品,加水溶解,滴加KSCN溶液,溶液顏色無明顯變化.再向試管中通入空氣,溶液逐漸變紅.由此可知:、 .
(2)為測定綠礬中結晶水含量,將石英玻璃管(帶端開關K1和K2)(設為裝置A)稱重,記為m1 g.將樣品裝入石英玻璃管中,再次將裝置A稱重,記為 m2 g.按下圖連接好裝置進行實驗.
①儀器B的名稱是 .
②將下列實驗操作步驟正確排序(填標號);重復上述操作步驟,直至A恒重,記為m3 g.
a.點燃酒精燈,加熱b.熄滅酒精燈c.關閉K1和K2
d.打開K1和K2 , 緩緩通入N2e.稱量Af.冷卻至室溫
③根據實驗記錄,計算綠礬化學式中結晶水數目x=(列式表示).若實驗時按a、d次序操作,則使x(填“偏大”“偏小”或“無影響”).
(3)為探究硫酸亞鐵的分解產物,將(2)中已恒重的裝置A接入下圖所示的裝置中,打開K1和K2 , 緩緩通入N2 , 加熱.實驗后反應管中殘留固體為紅色粉末.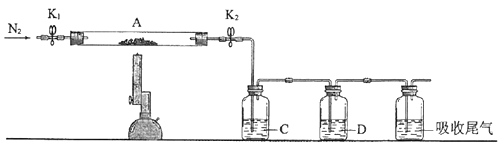
①C、D中的溶液依次為(填標號).C、D中有氣泡冒出,并可觀察到的現象分別為 .
a.品紅b.NaOHc.BaCl2d.Ba(NO3)2e.濃H2SO4
②寫出硫酸亞鐵高溫分解反應的化學方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se)是人體健康必需的一種微量元素。已知Se的原子結構示意圖為: 。下列說法不正確的是( )
。下列說法不正確的是( )
A. 該元素處于第四周期第ⅥA族 B. SeO2既有氧化性又有還原性
C. 該原子的質量數為34 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】古代哲學家們形成了不少有關物質構成的觀點,但最終都沒有成為科學,是因為
A.古人的思辨能力不強B.古人的觀點沒有實驗依據
C.古人的協作精神不強D.古人的分析推理能力較弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(15分)研究發現,在CO2低壓合成甲醇反應(CO2+3H2=CH3OH+H2O)中,Co氧化物負載的Mn氧化物納米粒子催化劑具有高活性,顯示出良好的應用前景.回答下列問題:
(1)Co基態原子核外電子排布式為 . 元素Mn與O中,第一電離能較大的是 , 基態原子核外未成對電子數較多的是 .
(2)CO2和CH3OH分子中C原子的雜化形式分別為和 .
(3)在CO2低壓合成甲醇反應所涉及的4種物質中,沸點從高到低的順序為 , 原因是 .
(4)硝酸錳是制備上述反應催化劑的原料,Mn(NO3)2中的化學鍵除了σ鍵外,還存在 .
(5)MgO具有NaCl型結構(如圖),其中陰離子采用面心立方最密堆積方式,X射線衍射實驗測得MgO的晶胞參數為a=0.420nm,則r(O2﹣)為nm.MnO也屬于NaCl型結構,晶胞參數為a'=0.448nm,則r(Mn2+)為nm.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據要求完成題目.
(1)與氬原子電子層結構相同的﹣2價陰離子的結構示意圖 .
(2)寫出含有6個質子,8個中子的原子的化學符號是 .
(3)用“<”或“>”填空:A.酸性:H2SO4HClO4 , B.堿性:Ca(OH)2Ba(OH)2
(4)用電子式表示氯化鎂的形成過程 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com