
【題目】由一種短周期金屬元素和一種非金屬元素組成的化合物X可與水發生復分解反應。某校興趣小組用如圖裝置(夾持裝置略去)對其進行探究實驗。
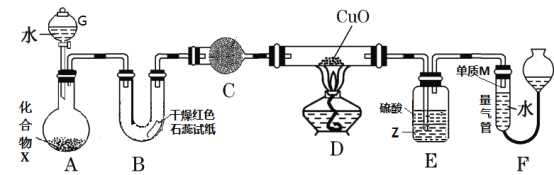
(1)儀器G的名稱是_____________________,B中紅色石蕊試紙變藍,則單質M的電子式為___________________。
(2)化合物X中金屬元素和非金屬元素質量比為69:14,寫出X與水反應的化學方程式:_________________________________。
(3)C中的試劑名稱為___________________________。
(4)實驗時,裝置D中硬質玻璃管內的現象為_________________________。
(5)裝置E中試劑Z為___________(填化學式),裝置E的作用是_________________。
(6)若不通過E、F兩裝置,請設計實驗方案證明D中發生了反應(不通過觀察D
中固體顏色發生變化)________________________________________ 。
(7)若裝置A中固體樣品含有雜質(雜質不參與反應),某同學通過測定F中單質M在標準狀況下的體積和固體樣品的質量,以確定固體樣品中X的質量分數,判斷該方案是否可行,并說明原因:_________________________________________________________________________________________。
【答案】分液漏斗![]() Na3N+3H2O=3NaOH+NH3↑ 堿石灰黑色粉末逐漸變為紅色,硬質玻璃管末端有水珠凝結CC14吸收未反應的NH3,并防止倒吸稱量反應前后硬質玻璃管內固體物質的質量不可行,因為裝置A中生成的氨氣不可能完全與 CuO反應
Na3N+3H2O=3NaOH+NH3↑ 堿石灰黑色粉末逐漸變為紅色,硬質玻璃管末端有水珠凝結CC14吸收未反應的NH3,并防止倒吸稱量反應前后硬質玻璃管內固體物質的質量不可行,因為裝置A中生成的氨氣不可能完全與 CuO反應
【解析】
(1)儀器G的名稱是分液漏斗;B中紅色石燕試紙變藍,則產生氨氣,氨氣與氧化銅加熱反應反應生成單質M為氮氣,其電子式為:![]() ;
;
(2)化合物X中含氮元素質量分數為16.9%,X應該為氮與活潑全屬形成的氮化物,則![]() ,
,![]() =23,則X為Na2N,Na3N與水反應的化學方程式為:Na3N+3H2O=3NaOH+NH3;
=23,則X為Na2N,Na3N與水反應的化學方程式為:Na3N+3H2O=3NaOH+NH3;
(3)中的試劑用于干燥氨氣,名稱為堿石灰;
(4)實驗時,裝置D中硬質玻璃管內的現象為黑色粉末逐漸變為紅色。硬質玻璃管未端有水珠凝結;
(5)裝置E中試劑Z為CCl4,裝置E的作用是吸收未反應的NH3并防止倒吸;
(6)若不通過E、F兩裝置,稱量反應前后硬質玻璃管內固體物質的質量,通過固體質量的變化證明D中發生了反應(不通過觀察D中園體顏色發生変化;
(7)若裝置A中國體樣品含有雜質(雜質不參與反應),某同學通過測定F中單質M在準狀況下的體積和固體樣品的質量,以確定固體樣品中X的質分數,方案不可行,因為裝置A中生成的気氣不可能完全與CuO反應。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:
【題目】下面是生產生活中的常見有機物的分子式、結構式、結構簡式或名稱有關說法正確的是
①![]() ②
②![]() ③
③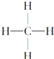 ④
④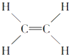 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白質 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液發生加成反應并使之褪色的有①②④⑩
B. 投入鈉能產生H2的是⑤⑦⑧⑨
C. 屬于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常溫下為液體且點燃時有濃煙的是①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,與14 g氫氣的體積相等的氮氣的( )
A. 質量為14 g
B. 物質的量為7 mol
C. 體積為22.4 L
D. 物質的量為14 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些有機物質的分子式采取適當變形會簡化計算.下列計算中錯誤的是( )
A. 等質量的甲烷、乙烯、乙炔充分燃燒,消耗的氧氣的物質的量依次增多
B. Wg葡萄糖充分燃燒后,燃燒產物經過足量的Na2O2充分反應,固體質量增加Wg
C. 乙酸和兩種鏈狀單烯烴混合物中氧的質量分數為a,則碳的質量分數是![]()
D. 等物質的量的乙醇與丙烯酸![]() 充分燃燒,消耗的氧氣的物質的量相同
充分燃燒,消耗的氧氣的物質的量相同
查看答案和解析>>
科目:高中化學 來源: 題型:
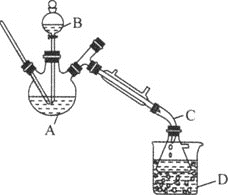
【題目】乙醚是有機合成中常用的溶劑。某實驗小組在實驗室利用乙醇脫水制備乙醚,裝置示意圖![]() 夾持和加熱裝置已略去
夾持和加熱裝置已略去![]() 、有關數據和實驗步驟如下:
、有關數據和實驗步驟如下:
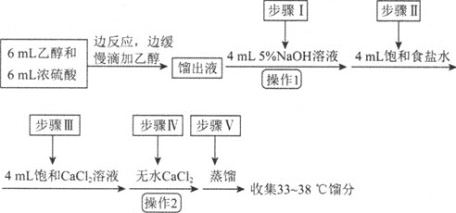
物質 | 相對分子質量 | 密度 | 沸點 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同條件下,乙醚在飽和食鹽水中比在水中更難溶。
②氯化鈣可與乙醇形成絡合物![]() 。
。
請回答下列問題:
(1)儀器C的名稱為_____。
(2)由乙醇制備乙醚的總反應為![]() ,此反應分兩步進行,第一步反應的化學方程式為
,此反應分兩步進行,第一步反應的化學方程式為![]() ,則第二步反應的化學方程式為_______。
,則第二步反應的化學方程式為_______。
(3)反應過程中,儀器B的末端應浸入反應液中,原因是___。
(4)儀器D中盛有冰水混合物,其作用為___。
(5)操作1的名稱為____,操作2的名稱為___。
(6)若省略步驟Ⅱ會導致的后果是_______。
(7)若實驗過程中共加入18mL乙醇,最終得到8.7g乙醚,則乙醚的產率為______![]() 計算結果精確到
計算結果精確到![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應2HI(g)![]() H2(g)+I2(g,紫色),下列敘述能夠說明已達平衡狀態的是( )
H2(g)+I2(g,紫色),下列敘述能夠說明已達平衡狀態的是( )
A. 混合氣體的質量不再變化
B. 溫度和體積一定時,容器內壓強不再變化
C. 1molH-H鍵斷裂的同時有2molH-I鍵斷裂
D. 各物質的物質的量濃度之比為2∶1∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com