
近年來,全球氣候變暖給人類的生存和發展帶來了嚴峻的挑戰,在此背景下,“新能源”、“低碳”、“節能減排”、“吃干榨盡”等概念愈來愈受到人們的重視。下列有關說法不正確的是( )
| A.太陽能、地熱能、生物質能和核聚變能均屬于“新能源” |
| B.“低碳”是指采用含碳量低的烴類作為燃料 |
C.下圖甲烷經一氯甲烷生成低碳烯烴的途徑體現了“節能減排”思想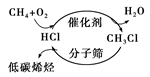 |
| D.讓煤變成合成氣,把煤“吃干榨盡”,實現了煤的清潔、高效利用 |
科目:高中化學 來源: 題型:單選題
關于下列各圖的敘述正確的是 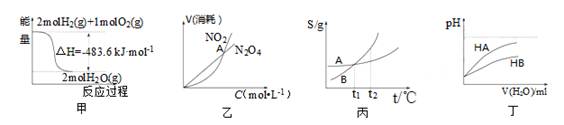
A.甲表示H2與O2發生反應過程中的能量變化,則H2的標準燃燒熱為△H=-483.6kJ·mol-1
B.乙表示恒溫恒容條件下發生的可逆反應2NO2 N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
N2O4(g)中,各物質的濃度與其消耗速率之間的關系,其中交點A對應的狀態為化學平衡狀態
C.丙表示A、B兩物質的溶解度隨溫度變化情況,將tl℃時A、B的飽和溶液分別升溫至t2℃時,溶質的質量分數B>A
D.丁表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則NaA溶液的pH小于同濃度的NaB溶液的pH
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列說法正確的是( )
| A.H2(g)的燃燒熱為 -571.6 kJ·mol-1 |
| B.同質量的H2(g)和CH3OH(l)完全燃燒,H2(g)放出的熱量多 |
C.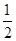 H2SO4(aq)+ H2SO4(aq)+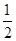 Ba(OH)2(aq)= Ba(OH)2(aq)= 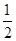 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知鹽酸與硫酸跟燒堿的稀溶液反應的熱化學方程式為:H+(aq)+OH-(aq) H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。則Q1和Q2的關系是( )
K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。則Q1和Q2的關系是( )
| A.Q1=Q2 | B.2Q1=Q2 | C.Q1<Q2 | D.無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在25℃、101 kPa條件下,C(s)、H2(g)、CH3COOH(l)的燃燒熱分別為393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,則2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反應熱為 ( )
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
人工光合作用能夠借助太陽能,用CO2和H2O制備化學原料。下圖是通過人工光合作用制備HCOOH的原理示意圖,下列說法不正確的是 ( )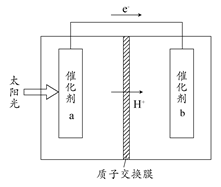
| A.該過程是將太陽能轉化為化學能的過程 |
| B.催化劑a表面發生氧化反應,有O2產生 |
| C.催化劑a附近酸性減弱,催化劑b附近酸性增強 |
| D.催化劑b表面的反應是CO2+2H++2e-=HCOOH |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關能源的說法錯誤的是( )。
| A.風能是人類通過風車等工具獲取的能源,但屬于一次能源 |
| B.在即將到來的新能源時代,核能、太陽能、氫能將成為主要能源 |
| C.月球土壤中含有豐富的質量數為3的氦,它可作為未來核能的重要原料 |
| D.原電池把化學能直接轉化為電能,所以由原電池提供的電能是一次能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的熱量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液時,放出的熱量是2.2 kJ。則Na2SO4溶液與BaCl2溶液反應的熱化學方程式為( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知:NH3·H2O(aq)與H2SO4(aq)反應生成1 mol正鹽的ΔH=-24.2 kJ·mol-1;強酸、強堿的稀溶液反應的中和熱為ΔH=-57.3 kJ·mol-1。則NH3·H2O在水溶液中電離的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com