
【題目】迄今為止我國相關部門已經發布了113號Nh、115號Mc、116號Lv、117號Ts、118號Og等元素的中文名稱分別是:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,下列有關推斷正確的是( )
,下列有關推斷正確的是( )
A.這五種元素均為主族元素
B.Nh的最高價氧化物是一種典型的兩性氧化物
C.Ts的簡單陰離子比該族上一周期簡單陰離子的還原性弱
D.根據該名稱,周期表118種元素中非金屬元素共有24種
科目:高中化學 來源: 題型:
【題目】我國秦俑彩繪和漢代器物上用的顏料被稱為“中國藍”、“中國紫”,直到近年來人們才研究出來其成分為BaCuSi4O10,BaCuSi2O6。
(1)“中國藍”、“中國紫”中均具有Cun+離子,n=___,基態時該陽離子的價電子排布式為______。
(2)“中國藍”的發色中心是以Cun+為中心離子的配位化合物,其中提供孤對電子的是___元素。
(3)合成“中國藍”、“中國紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶體中Si原子的雜化軌道是由______軌道(填軌道的名稱和數目)和________軌道雜化而成的。
(4)現代文物分析發現,“中國藍”中含有微量硫元素。假若硫元素來源一種陰離子是正四面體的天然鋇礦中,則最可能的鋇礦化學式是______。
(5)在5500年前,古代埃及人就己經知道如何合成藍色顏料—“埃及藍”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中國藍”一致。CO32一中鍵角∠OCO為___。根據所學,從原料分解的角度判斷“埃及藍”的合成溫度比“中國藍”更___(填“高”或“低”)。
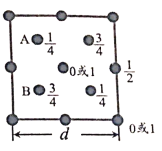
(6)自然界中的SiO2,硬度較大,主要原因是___。下圖為SiO2晶胞中Si原子沿z軸方向在xy平面的投影圖(即俯視投影圖),其中O原子略去,Si原子旁標注的數字表示每個Si原子位于z軸的高度,則SiA與SiB的距離是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳捕集與封存是應對氣候變化問題的解決方案之一。回答下列問題:
(l)我國科研團隊利用低溫等離子體協同催化技術,在常溫常壓下實現了將CO2和CH4一步轉化為化工產品。試寫出 CO2與CH4合成乙酸的熱化學方程式:____。
(甲烷和乙酸的燃燒熱分別為-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一鋼性密閉容器中CH4、CO2的分壓分別為15 kPa、20 kPa,加入Ni/α-Al2 O3催化劑并加熱至1123 K使其發生反應:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某時刻測得p(H2)=10 kPa,則 p(CH4)=___kPa,v(CO)=___kPa
s-1),某時刻測得p(H2)=10 kPa,則 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②達到平衡后測得體系壓強是起始時的![]() ,則該反應的平衡常數Kp=____kPa)2。
,則該反應的平衡常數Kp=____kPa)2。
(3)氮化鎵(GaN)與Cu可組成如圖所示的人工光合系統,該裝置能以CO2和H2O為原料合成CH4。
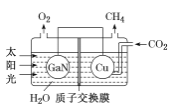
①該裝置工作時H+移向____(填“GaN”或“Cu”)電極,該電極上的電極反應式為 ___。
②該裝置每產生1 mol CH4,左極室溶液質量減少____g。
③本實驗條件下,若CO2轉化為烴(如甲烷、乙烯等)的轉化率為10%,生成CH4的選擇性為12%,現收集到12 mol CH4,則通入的CO2為____mol。(已知:選擇性=生成目標產物消耗的原料量/原料總的轉化量)
(4)上述人工光合系統裝置也可以制備乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面選擇加氫的反應機理,如下圖所示。其中吸附在Pd表面的物質用“*”標注。
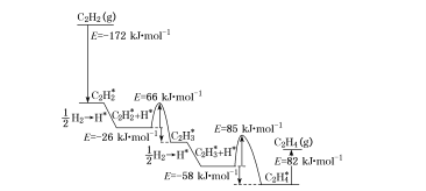
上述吸附反應為 ____填“吸熱”或“放熱”)反應,該過程中最小能壘(活化能)為___ kJ![]() mol-1,該步驟的化學方程式為____。
mol-1,該步驟的化學方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】萜類化合物廣泛存在于動植物體內,關于下列萜類化合物的說法正確的是( )

A. a和b都屬于芳香族化合物
B. a和c分子中所有碳原子均處于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能與新制的Cu(OH)2反應生成紅色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷水蒸氣重整和水氣變換是傳統的制氫方法,反應如下 :
①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 4 1 kJmol-1
近期報道,用二氧化碳作為氧化劑和甲烷重整制氫的新反應路線如下,可生成適宜 H2/ CO 的合成氣。
③CH4 (g)+CO2 (g)2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反應③CH4的平衡轉化率條件是______________。
A. 升高溫度,同時對原料氣進行加壓 B. 降低溫度,同時對原料氣進行加壓
C. 升高溫度,同時用氬氣稀釋原料氣 D. 降低溫度,同時用氬氣稀釋原料氣
(2)重整反應器中以上三個反應都在發生,不同反應條件下達到平衡時的進程如下:
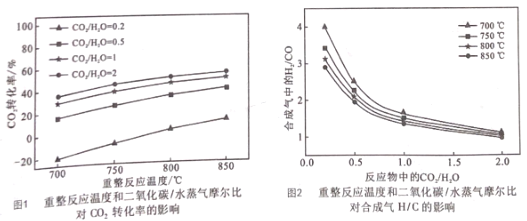
I.根據圖1,在_________ ( 填寫反應條件)時CO2的轉化率為負值,主要原因:一是 CO2穩定性較高,低濃度時難以和甲烷反應;二是 ___________。
II.根據圖,2隨著反應溫度和反應物中![]() 的提高,體系中反應____填①、②、③)逐漸占據主導。若 850℃、
的提高,體系中反應____填①、②、③)逐漸占據主導。若 850℃、![]() 為0.5時重整反應器中達到平衡時,體系中CO2和水蒸氣濃度相等,求此條件下反應②的平衡常數K=__。
為0.5時重整反應器中達到平衡時,體系中CO2和水蒸氣濃度相等,求此條件下反應②的平衡常數K=__。
(3)固體氧化物電解池(傳導O2-)將CO2 和H2O 轉化為n(H2):n(CO)=1的合成氣并聯產高純度O2,寫出電解池陰極反應式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.乳酸薄荷醇酯(![]() )僅能發生水解、氧化、消去反應
)僅能發生水解、氧化、消去反應
B.乙醛和丙烯醛(![]() )不是同系物,它們與氫氣充分反應后的產物也不是同系物
)不是同系物,它們與氫氣充分反應后的產物也不是同系物
C.已知冰的熔化熱為6.0kJ/mol,冰中氫鍵鍵能為20kJ/mol。假設每摩爾冰中有2mol氫鍵,且熔化熱完全用于打破冰的氫鍵,則最多只能破壞冰中15%的氫鍵
D.CH3COOCH2CH3與CH3CH2COOCH3互為同分異構體,1H-NMR譜顯示兩者均有三種不同的氫原子且三種氫原子的比例相同,故不能用1H-NMR來鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學小組的同學開展測定Na2SO3和NaCl的固體混合物中Na2SO3質量分數的探究實驗,他們提出下列實驗方案:

(1)小明同學用圖中的發生、收集裝置。甲、乙兩試管各有兩根導管,連接對應接口后,倒置盛稀硫酸的試管,發生反應,放出氣體。則稀硫酸應置于____中(填“甲”或“乙”);G管可以用化學實驗室里的一種常用儀器代替,你認為這種儀器的名稱是____。儀器甲、乙接口的連接方式如下:A連接___,C連接F;(填寫接口的編號)
(2)小李同學用沉淀法測定Na2SO3的質量分數。
操作流程:

①操作Ⅱ的名稱是_______。
②操作Ⅰ之前,為判斷所加BaCl2溶液是否過量, 設計如下方案,其中最合理的是___。
A.取少量上層清液,繼續滴加稀H2SO4,若沉淀產生則說明BaCl2已過量。
B.待濁液澄清后,繼續滴加BaCl2,若無沉淀產生則說明BaCl2已過量。
C.待濁液澄清后,繼續滴加稀H2SO4,若沉淀產生則說明BaCl2已過量。
③根據以上數據得出Na2SO3的質量分數為_____。
④小麗同學經認真分析,上述實驗操作均正確,但發現實驗結果與預期相差較大,請你推測可能的原因是______,驗證方法__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是()
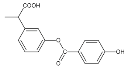
①分子式為C16H14O5 ②能使酸性高錳酸鉀溶液褪色 ③能發生加成反應,但不能發生取代反應 ④苯環上的一溴代物有6種 ⑤1mol 該有機物與NaOH反應時最多消耗4mol NaOH ⑥1mol該有機物在一定條件下和H2反應,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個固定體積均為1 L密閉容器中以不同的氫碳比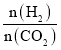 充入H2和CO2,在一定條件下發生反應:2CO2(g)+6H2(g)
充入H2和CO2,在一定條件下發生反應:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡轉化率α(CO2)與溫度的關系如圖所示。下列說法正確的是 ( )
C2H4(g)+4H2O(g) ΔH。CO2的平衡轉化率α(CO2)與溫度的關系如圖所示。下列說法正確的是 ( )
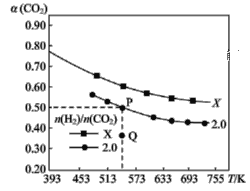
A.該反應在常溫下不可能自發進行
B.氫碳比,X<2.0
C.若起始時CO2、H2濃度分別為0.5 mol·L-1、1.0 mol·L-1,則可得P點對應溫度的平衡常數的值為512
D.向P點狀態的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后α(CO2)減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com