
【題目】科學家合成出了一種用于分離鑭系金屬的化合物 A,其結構如下圖所示。短周期元素 X、Y、Z原子序數依次增大,其中Z位于第三周期。Z與Y可以形成分子 ZY6,該分子常用作高壓電氣設備的絕緣介質。下列關于X、Y、Z的敘述,正確的是

A.化合物 A中,X、Y、Z最外層都達到8電子穩定結構
B.離子半徑:Y>Z
C.最簡單氫化物的沸點:Z>Y
D.最高價氧化物對應水化物的酸性:Z<X
【答案】A
【解析】
根據圖示A的結構可知,正離子中Z失去一個電子后形成3個共價鍵,說明Z原子最外層為6個電子,且Z位于第三周期,則Z為S;負離子中Y形成一個共價鍵,為-1價,不是第三周期元素,且原子序數大于X,應為F(當然不是H,因為正離子已經有H);X得到一個電子形成4個共價鍵,說明其最外層為3個電子,則X為B元素,據此解答。
根據分析可知,X為B,Y為F,Z為S元素;
A.結合分析可知,化合物A分子中B、F、S元素最外層都達到8電子穩定結構,其中B原子周圍形成3個共價鍵和1個配位芻鍵,故A正確;
B.電子層越多離子半徑越大,則離子半徑F-<S2-,即Y<Z,故B錯誤;
C.在標準狀況下,HF為液體,而H2S為氣體,則最簡單氫化物的沸點:HF>H2S,即Y >Z,故C錯誤;
D.非金屬性越強,最高價含氧酸的酸性越強,非金屬性:B<S,則最高價氧化物對應水化物的酸性:H3BO3(弱酸)<H2SO4(強酸),即X<Z,故D錯誤;
故答案為A。


科目:高中化學 來源: 題型:
【題目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面體結構,PCl5中P-Cl鍵的鍵能為ckJ·mol-1,PCl3中P-Cl鍵的鍵能為1.2ckJ·mol-1
下列敘述正確的是( )
A.P-P鍵的鍵能大于P-Cl鍵的鍵能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反應熱ΔH
C.Cl-Cl鍵的鍵能![]() kJ·mol-1
kJ·mol-1
D.P-P鍵的鍵能為![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在有關限定條件下溶液中一定能大量共存的是( )
A. 由水電離產生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常溫下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20℃時,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分數δ隨溶液pH變化的關系如圖所示。下列說法正確的是( )

A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q點:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P點:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 該溫度下H2C2O4的電離常數Ka2=1×10-4.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是四種原子序數依次增大的短周期元素,W、X兩種元索可組成W2x和W2X2兩種常見的無色液體化合物, Y2X2為淡黃色固體化合物,Z的原子序數是X的原子序數的兩倍。請回答下列問題:
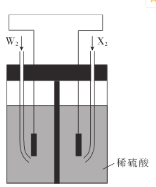
(1)Z元素的名稱是___________ 。
(2)W、X、Y三種元素形成的化合物的電子式_____________
(3)寫出Y2X2中所含化學鍵有:___________。
(4)寫出Y2X2和W2X反應的化學方程式:_______________
(5)W2和X2是組成某種燃料電池的兩種常見物質,如圖所示,通人X2的電極是___(填“正極”或“負極”),寫出通人W2的電極的電極反應式:________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式次氯酸鎂[Mg2ClO(OH)3·H2O]微溶于水,不吸濕,相對穩定,是一種有開發價值的無機抗菌劑。某研發小組通過下列流程制備堿式次氯酸鎂:
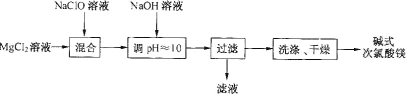
(1)從上述流程中可以判斷,濾液中可回收的主要物質是__________。
(2)NaClO溶液用Cl2與NaOH溶液反應獲得,寫出該反應的化學方程式:_____。
(3)有效氯的含量是衡量次氯酸鹽氧化能力的重要指標。次氯酸鹽的有效氯含量可用次氯酸鹽與鹽酸反應所生成的氯氣的含量來表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若測得某堿式次氯酸鎂產品中鎂含量為29.01%,有效氯含量為40.28%。
,若測得某堿式次氯酸鎂產品中鎂含量為29.01%,有效氯含量為40.28%。
①通過計算判斷該產品中鎂和有效氯含量的測定值與理論值相比,是偏高或偏低?(寫出計算過程)_____________
②根據你的判斷,推測產品中可能含有的雜質,并給出制備過程能減少產品中含有該雜質的措施_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的轉化關系如下圖所示。A為一種黃綠色的氣體,B為常見的無色液體,H為一種助燃的氣體,F為一種氣體,它在A中燃燒產生蒼白色火焰,E為一種能被磁鐵吸引的金屬。
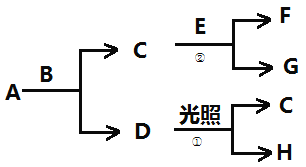
(1)B的化學式為____________。
(2)F的化學式為____________。
(3)寫出反應②的化學方程式:_______________________________。
(4)寫出反應①的化學方程式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某溫度時,將 n mol·L-1氨水滴入 10 mL 1.0 mol·L-1鹽酸中,溶液 pH 和溫度隨加入氨水體積變化曲線如圖所示。下列有關說法錯誤的是
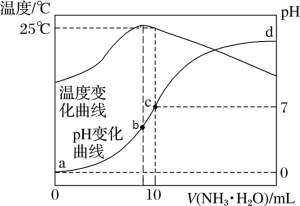
A.c 點存在守恒關系:c(NH4+)=c(Cl-)
B.b 點:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.水的電離程度:b > c > a > d
D.25℃時 ,NH4Cl 水解平衡常數為(n-1)×10-7(用 n 表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式正確的是( )
A.鐵與鹽酸反應:2Fe+6H+==2 Fe3++ H2↑
B.在氯化鋁溶液中滴加過量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化鐵溶液中加入鐵粉:Fe3++Fe=2Fe2+
D.氯化鐵溶液與氫氧化鈉溶液反應:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com