
工業上制備H2的一種重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知該反應的平衡常數K與溫度T的關系如圖所示。若在一固定的密閉容器中, 850℃ 時發生上述反應,測得容器內各物質的濃度 (mol/L)隨時間的變化關系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知該反應的平衡常數K與溫度T的關系如圖所示。若在一固定的密閉容器中, 850℃ 時發生上述反應,測得容器內各物質的濃度 (mol/L)隨時間的變化關系如下表: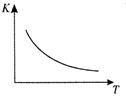
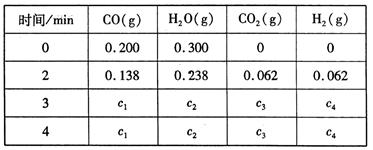
已知:850℃ 時該反應的化學平衡常數K ="1.0" ,請回答下列問題:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判斷該反應達到化學平衡狀態的敘述是 (填字母)。
| A.單位時間內減少 CO(g)的濃度等于生成 CO2 (g)的濃度 |
| B.反應容器內的壓強不發生變化 |
| C.混合氣體中 H2 (g)的濃度不再發生改變 |
| D.氫氣的生成速率等于水的生成速率 |
科目:高中化學 來源: 題型:填空題
捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用。目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
請回答下列問題:
(2)為研究溫度對(NH4)2CO3捕獲CO2效率的影響,在某溫度T1下,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體(用氮氣作為稀釋劑),在t時刻,測得容器中CO2氣體的濃度。然后分別在溫度為T2、T3、T4、T5下,保持其他初始實驗條件不變,重復上述實驗,經過相同時間測得CO2氣體濃度,得到趨勢圖(見圖1)。則:
①ΔH3________0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5兩個溫度區間,容器內CO2氣體濃度呈現如圖1所示的變化趨勢,其原因是____________________________________________________________________________。
③反應Ⅲ在溫度為T1時,溶液pH隨時間變化的趨勢曲線如圖2所示。當時間到達t1時,將該反應體系溫度迅速上升到T2,并維持該溫度。請在該圖中畫出t1時刻后溶液的pH變化總趨勢曲線。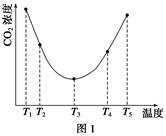

(3)利用反應Ⅲ捕獲CO2,在(NH4)2CO3初始濃度和體積確定的情況下,提高CO2吸收量的措施有________________________(寫出2個)。
(4)下列物質中也可能作為CO2捕獲劑的是__________。
| A.NH4Cl | B.Na2CO3 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知:2NO2(g) N2O4(g);△H<0。在恒溫恒容條件下,將一定量NO2和N2O4的混合氣體通入容積為2L的密閉容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如圖⑴所示。請回答:
N2O4(g);△H<0。在恒溫恒容條件下,將一定量NO2和N2O4的混合氣體通入容積為2L的密閉容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如圖⑴所示。請回答:
(1)a點時,v(正) v(逆)(填“<”、“>”或“=”),X線、Y線中代表N2O4的是 ;
(2)反應在第10 min達到平衡,則前10 min內用NO2表示的化學反應速率v(NO2)= mol·L-1·min-1。該溫度下,反應的平衡常數K= (可用分數表示);
(3)在第25分鐘,進行的操作是 ;
(4)a、b、c、d四點對應的時刻,NO2物質的量濃度由小到大的順序是 ,再次平衡時的d點NO2的體積分數比b點時 (填“大”、“小”或“相等”);
(5)假如在第35分鐘從容器中移去0.4mol N2O4,并加入適當催化劑使反應在第40分鐘達到平衡,請在圖⑴中畫出從第35分鐘以后兩種物質的物質的量濃度c隨時間t的變化關系,并標注所畫線條對應的物質。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在10 L的密閉容器中,進行如下化學反應:CO2(g)+H2(g) CO(g)+H2O(g)其化學平衡常數K和溫度t的關系如下表:
CO(g)+H2O(g)其化學平衡常數K和溫度t的關系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上采用乙苯與CO2脫氫生產重要化工原料苯乙烯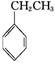 (g)+CO2(g)
(g)+CO2(g)
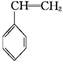 (g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1
(1)①乙苯與CO2反應的平衡常數表達式為:K= 。
②若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是 (填代號)。 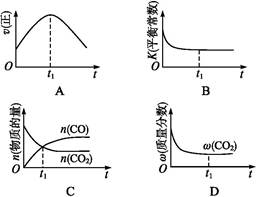
(2)在3 L密閉容器內,乙苯與CO2的反應在三種不同的條件下進行實驗,乙苯、CO2的起始濃度分別為1.0 mol·L-1和3.0 mol·L-1,其中實驗Ⅰ在T1℃,0.3 MPa,而實驗Ⅱ、Ⅲ分別改變了實驗其他條件;乙苯的濃度隨時間的變化如圖1所示。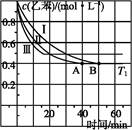
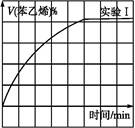
圖1 圖2
①實驗Ⅰ乙苯在0~50 min時的反應速率為 。
②實驗Ⅱ可能改變的條件是 。
③圖2是實驗Ⅰ中苯乙烯體積分數V%隨時間t的變化曲線,請在圖2中補畫實驗Ⅲ中苯乙烯體積分數V%隨時間t的變化曲線。
(3)若實驗Ⅰ中將乙苯的起始濃度改為1.2 mol·L-1,其他條件不變,乙苯的轉化率將 (填“增大”“減小”或“不變”),計算此時平衡常數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知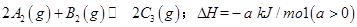 ,在一個有催化劑的固定容積的容器中加入2mol
,在一個有催化劑的固定容積的容器中加入2mol 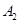 和1mol
和1mol 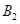 ,在500℃時充分反應達平衡后
,在500℃時充分反應達平衡后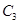 的濃度為w mol/L,放出熱量b kJ。
的濃度為w mol/L,放出熱量b kJ。
(1)比較a______b(填>、=、<)
(2)下表為不同溫度下該反應的平衡常數。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)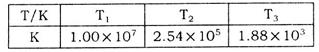
若在原來的容器中,只加入2mol 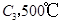 時充分反應達平衡后,吸收熱量ckJ,
時充分反應達平衡后,吸收熱量ckJ, 的濃度________(填>、=、<)w mol/L。
的濃度________(填>、=、<)w mol/L。
(3)在相同條件下要想得到2akJ熱量,加入各物質的物質的量可能是
A.4mol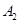 和2mol
和2mol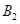 B.4mol
B.4mol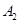 、2mol
、2mol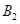 和2mol
和2mol 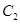
C.4mol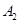 和4mol
和4mol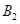 D.6mol
D.6mol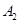 和4mol
和4mol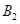
(4)為使該反應的反應速率增大,且平衡向正反應方向移動的是___________。
A.及時分離出 氣體 B.適當升高溫度
氣體 B.適當升高溫度
C.增大 的濃度 D.選擇高效的催化劑
的濃度 D.選擇高效的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g) 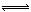 CH3OH(g)。
CH3OH(g)。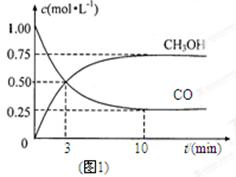
(1)圖1是表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化情況。從反應開始到平衡,用CO濃度變化表示平均反應速率v(CO)= ; H2的平衡轉化率為_________________________。
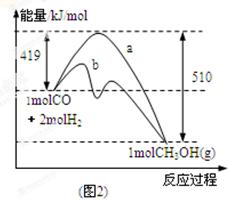
(2)圖2表示該反應進行過程中能量的變化。曲線a表示不使用催化劑時反應的能量變化,曲線b表示使用催化劑后的能量變化。寫出反應的熱化學方程式 。
(3)該溫度下,反應平衡常數K=______________(填數值),溫度升高,平衡常數K_________(填“增大”、“不變”或“減小”)。
(4)恒容條件下,下列措施中能使反應體系中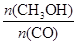 增大的措施有 。
增大的措施有 。
a.升高溫度 b.充入He氣 c.再充入2 molH2 d.使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體。工業上有一種用CO來生產甲醇燃料的方法: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
某科學實驗將6molCO2和8molH2充入2L的密閉容器中,測得H2的物質的量隨時間變化如下圖所示(實線)。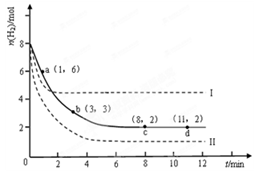
(1)a點正反應速率_______(填大于、等于或小于)逆反應速率。
(2)下列時間段平均反應速率最大的是__________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示_____________,K值大小與溫度的關系是:溫度升高,K值______________(填“一定增大”、“一定減小”、或“可能增大也可能減小”)。
(2)在一體積為10L的容器中,通人一定量的CO和H2O,在850℃時發生如下反應:CO(g)十H2O(g) 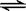 CO2(g)十H2 (g) △H < 0 ;CO和H2O濃度變化如下圖,則 0—4min的平均反應速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O濃度變化如下圖,則 0—4min的平均反應速率v(CO)=______ mol/(L·min)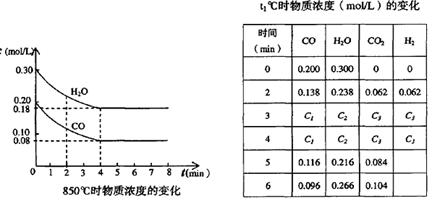
(3)t℃(高于850℃)時,在相同容器中發生上述反應,容器內各物質的濃度變化如上表。
①表中3min—4min之間反應處于_________狀態; C1數值_________0.08 mol/L (填大于、小于或等于)。
②反應在4min—5min問,平衡向逆方向移動,可能的原因是________(單選), 表中5min—6min之間數值發生變化,可能的原因是__________(單選)。
| A.增加水蒸氣 | B.降低溫度 |
| C.使用催化劑 | D.增加氫氣濃度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com