
【題目】4℃時500 mL水中溶解了112L氯化氫氣體(在標準狀況下測得)。下列關于所形成溶液的說法中正確的是( )
A.該溶液溶質的物質的量濃度為10mol·L1
B.該溶液溶質的質量分數約為26.7%
C.該溶液溶質的物質的量濃度因溶液的密度未知而無法求得
D.該溶液溶質的質量分數因溶液的密度未知而無法求得
【答案】BC
【解析】
4℃時水的密度為1g/ml,112L氯化氫氣體的物質的量為![]() =5mol,據此分析判斷。
=5mol,據此分析判斷。
A. 由分析可知氯化氫氣體的物質的量為5mol,溶質溶液的體積未知,因此無法計算溶液的濃度,A項錯誤;
B. 112L氯化氫氣體的物質的量為5mol,溶質的質量為5mol×36.5mol/L=182.5g,溶液的質量為500g+182.5g=682.5g,因此溶質的質量分數為![]() ×100%=26.7%,B項正確;
×100%=26.7%,B項正確;
C. 溶液的密度未知,無法計算溶液的體積,因此不能計算物質的量濃度,C項正確;
D. 根據已知條件可計算溶質和溶液的質量,根據公式可以計算質量分數,D項錯誤;
答案選BC。


科目:高中化學 來源: 題型:
【題目】關于一些重要的化學概念有下列說法,其中正確的是( )
①Fe(OH)3膠體和CuSO4溶液都是混合物 ②BaSO4是一種難溶于水的強電解質 ③冰醋酸、純堿、小蘇打分別屬于酸、堿、鹽 ④煤的干餾、煤的氣化和液化都屬于化學變化 ⑤置換反應都屬于離子反應
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學采用硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)制取七水合硫酸亞鐵(FeSO4·7H2O),設計了如下流程:

下列說法不正確的是
A. 溶解燒渣選用足量硫酸,試劑X選用鐵粉
B. 固體1中一定含有SiO2;控制pH是為了使Al3+轉化為A1(OH)3進入固體2
C. 若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO4·7H2O
D. 從溶液2得到FeSO4·7H2O產品的過程中,須控制條件防止其氧化和分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某Al2(SO4)3溶液VmL中含有a克Al3+,取出![]() mL溶液稀釋成3VmL后,硫酸根離子的物質的量濃度為_________。
mL溶液稀釋成3VmL后,硫酸根離子的物質的量濃度為_________。
(2)在標準狀況下,CO和CO2混合氣體的質量為36g,體積為22.4L,則其中CO2所占的體積為______,CO所占的質量為______。
(3)某無土栽培用的營養液,要求KCl、K2SO4和NH4Cl三種固體原料的物質的量之比為1:4:8。
①配制該營養液后c(NH4+)=0.016mol/L,溶液中c(K+)=_______________。
②若采用(NH4)2SO4和KCl來配制該營養液,則(NH4)2SO4和KCl物質的量之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗和現象,所得實驗結論正確的是( )
選項 | 實驗 | 現象 | 實驗結論 |
A | 向某溶液中先滴加適量稀硝酸,再滴加少量BaCl2溶液 | 出現白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一種或幾種 |
B | 將純堿和硫酸反應生成的氣體,通入一定濃度的Na2SiO3溶液中 | 出現白色膠狀沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
C |
| 左邊棉球變為橙色,右邊棉球變為藍色 | 氧化性:Cl2>Br2>I2 |
D |
| 試管a出現白色沉淀,試管b出現黃色沉淀 | 溶度積:Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NH4HCO3受熱易分解,化學方程式NH4HCO3=NH3↑+CO2↑+H2O。發酵粉是制作糕點的常見膨脹劑,某發酵粉的主要成分是NH4HCO3、NaHCO3,某學生稱取干燥的此發酵粉50g,充分加熱至質量不再改變,稱取殘留固體質量26.5g,該發酵粉中NaHCO3與NH4HCO3的質量比為( )
A.4:21B.8:21C.21:4D.84:79
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,單質A、B、C分別為固體、黃綠色氣體、無色氣體,在合適的反應條件下,它們可按下面框圖進行反應。又知D溶液為黃色,E溶液為無色,請回答:
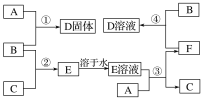
(1)A是__________,B是__________,C是_______________(填寫化學式)。
(2)反應①的化學方程式為_______________________________。
(3)反應③的化學方程式為________________________________________。
(4)反應④的化學方程式為____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丹參醇是中藥丹參中的一種天然產物。合成丹參醇的部分路線如下:
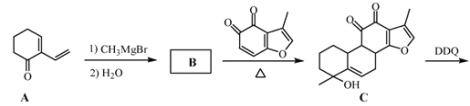

已知:![]()
(1)A中的官能團名稱為___、___。
(2)D![]() E的反應類型為___。
E的反應類型為___。
(3)B的分子式為C9H14O,寫出B的結構簡式:___。
(4)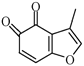 的一種同分異構體同時滿足下列條件,寫出該同分異構體的結構簡式:___。
的一種同分異構體同時滿足下列條件,寫出該同分異構體的結構簡式:___。
①分子中含有苯環,能與FeCl3溶液發生顯色反應,不能發生銀鏡反應;
②堿性條件水解生成兩種產物,酸化后分子中均只有2種不同化學環境的氫。
(5)寫出以![]() 和
和![]() 為原料制備
為原料制備![]() 的合成路線流程圖(無機試劑和乙醇任用,合成路線流程圖示例見本題題干)。___
的合成路線流程圖(無機試劑和乙醇任用,合成路線流程圖示例見本題題干)。___
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組欲探究反應2Fe2++I2![]() 2Fe3++2I,完成如下實驗:
2Fe3++2I,完成如下實驗:
資料:AgI是黃色固體,不溶于稀硝酸。新制的AgI見光會少量分解。
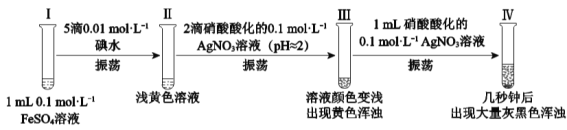
(1)Ⅰ、Ⅱ均未檢出Fe3+,檢驗Ⅱ中有無Fe3+的實驗操作及現象是:取少量Ⅱ中溶液,___。
(2)Ⅲ中的黃色渾濁是__。
(3)經檢驗,Ⅱ→Ⅲ的過程中產生了Fe3+。
①對Fe3+產生的原因做出如下假設:
假設a:空氣中存在O2,由于___(用離子方程式表示),可產生Fe3+;
假設b:酸性溶液中NO3具有氧化性,可產生Fe3+;
假設c:___;
假設d:該條件下,I2溶液可將Fe2+氧化為Fe3+。
②通過實驗進一步證實a、b、c不是產生Fe3+的主要原因,假設d成立。Ⅱ→Ⅲ的過程中I2溶液氧化Fe2+的原因是___。
(4)經檢驗,Ⅳ中灰黑色渾濁中含有AgI和Ag。
①驗證灰黑色渾濁含有Ag的實驗操作及現象是:取洗凈后的灰黑色固體,___。
②為探究Ⅲ→Ⅳ出現灰黑色渾濁的原因,完成了實驗1和實驗2。
實驗1:向1mL0.1 mol·L1 FeSO4溶液中加入1mL0.1mol·L1AgNO3溶液,開始時,溶液無明顯變化。幾分鐘后,出現大量灰黑色渾濁。反應過程中溫度幾乎無變化。測定溶液中Ag+濃度隨反應時間的變化如圖。

實驗2:實驗開始時,先向試管中加入幾滴Fe2(SO4)3溶液,重復實驗1,實驗結果與實驗1相同。
ⅰ.實驗1中發生反應的離子方程式是___。
ⅱ.Ⅳ中迅速出現灰黑色渾濁的可能的原因是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com