
【題目】科學家合成一種新化合物(如圖所示)。

其中W、X、Y、Z為同周期元素,W是所在周期中第一電離能最小的元素,Y元素基態原子的未成對電子數等于其電子層數,Z元素的原子核外最外層電子數是X核外電子數的一半。
回答下列問題:
(1)W、X、Y、Z原子半徑由大到小的順序為__(用對應的元素符號表示)。
(2)Z的核外電子排布式為__。
(3)基態X原子價電子軌道表示式為__。
(4)W元素基態原子核外電子有__種運動狀態,其中電子占據能量最高的原子軌道符號表示為__。
(5)X的電負性__(填“大于”或“小于”)Y,原因是__。
【答案】Na>Si>P>Cl 1s22s22p63s23p5或[Ne]3s23p5 ![]() 11 3s 小于 同周期元素P比Si原子半徑小,核電荷數多,吸引電子能力更強
11 3s 小于 同周期元素P比Si原子半徑小,核電荷數多,吸引電子能力更強
【解析】
W、X、Y、Z為同一短周期元素,據圖可知X能形成4個共價鍵,則應為第IVA族元素,Z核外最外層電子數是X核外電子數的一半,則X核外電子數最大為14(Z不可能為0族元素),則X為C或Si,若X為C,則Z為B,不符合圖示成鍵規律,所以X為Si,Z為Cl,四種元素位于第三周期;Y元素基態原子的未成對電子數等于其電子層數,則Y核外電子排布為1s22s22p63s23p3,即為P元素;根據圖示可知,W元素的陽離子帶一個正電荷,且W是所在周期中第一電離能最小的元素,則W為Na元素。
通過分析知,W、X、Y、Z分別為Na、Si、P、Cl元素。
(1)同一周期從左向右原子半徑逐漸減小,則W、X、Y、Z原子半徑由大到小的順序為:Na>Si>P>Cl;
(2)Cl的核外電子數=核電荷數=17,Cl的核外電子排布式為:1s22s22p63s23p5;
(3)Si處于周期表中第3周期第ⅣA族,基態Si的價電子排布式為3s23p2,則基態硅原子價電子的軌道表示式是:![]() ;
;
(4)Na的核外電子總數=原子序數=11,每個電子的運動狀態都不同,則Na原子有11種不同的運動狀態;Na元素基態原子中能量最高的電子所占據的原子軌道為3s;
(5)同周期元素P比Si原子半徑小,核電荷數多,吸引電子能力更強,所以Si的電負性小于P。


科目:高中化學 來源: 題型:
【題目】現有屬于前四周期的A、B、C、D、E、F、G七種元素,原子序數依次增大。A元素的價電子構型為nsnnpn+1;C元素為最活潑的非金屬元素;D元素核外有三個電子層,最外層電子數是核外電子總數的![]() ;E元素正三價離子的3d軌道為半充滿狀態;F元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子;G元素與A元素位于同一主族,其某種氧化物有劇毒。
;E元素正三價離子的3d軌道為半充滿狀態;F元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子;G元素與A元素位于同一主族,其某種氧化物有劇毒。
(1)A、B、C三種元素的第一電離能由小到大的順序為____________ (用元素符號表示);A、B、C三種元素的簡單氫化物的穩定性順序為:_______(用化學式表示)。
(2)D元素原子的價電子排布式是________,估計D元素的第2次電離能飛躍數據將發生在失去第______個電子時。
(3)C元素的電子排布圖為______。E的外圍電子排布為_______ ,E原子的結構示意圖為_______。
(4)F元素位于元素周期表的_______區,其基態原子的電子排布式為________。
(5)G元素可能的性質________。
A 其單質可作為半導體材料 B 其電負性大于磷
C 其原子半徑大于鍺 D 其第一電離能小于硒
(6)電離能比較:I1(Mg)________I1(Al)(填“>”或“<”),其原因______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物F(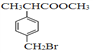 )是合成某種藥物的中間體,它的一種合成路線如下:
)是合成某種藥物的中間體,它的一種合成路線如下:
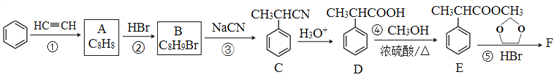
回答下列問題:
(1)A的結構簡式為______,分子中處于同一平面的原子最多有____個。
(2)E中官能團名稱是_____,①~④中屬于加成反應的是_______(填序號)。
(3)反應③的化學方程式為______________。
(4)反應⑤的生成物有兩種,除了F以外,另一種生成物的名稱是______。
(5)滿足下列條件的D的同分異構體有______種。
①能與FeCl3溶液發生顯色反應; ②能發生銀鏡反應; ③分子中有1個甲基
(6)仿照E的合成路線,設計一種由![]() 合成
合成![]() 的合成路線_________________。
的合成路線_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】m、n、p、q、w五種元素,其核電荷數依次增大。m元素基態原子核外只有三個能級,且各能級電子數相等,p、q元素位于同一族,且兩者核電荷數之和為24,w元素原子核外有4個電子層,最外層只有1個電子,其余各層均排滿電子。下列說法錯誤的是( )
A.m、n、p元素第一電離能依次增大
B.基態n元素原子的軌道表示式為:![]()
C.w元素原子的價電子排布式為4s1
D.w單質分別與p、q單質反應,產物中w的化合價不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】侯氏制堿法(聯合制堿法)工藝流程可用圖表示。
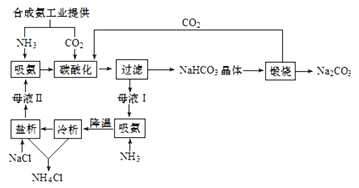
下列有關說法正確的是( )
A.合成氨工業提供的CO2來自焦炭燃燒
B.母液Ⅰ“吸氨”可抑制NH4+水解
C.CO2、NH3和H2O都得到循環利用
D.“冷析”和“鹽析”降低了NH4Cl溶解度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某可逆反應mA(g)+nB(g) ![]() pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數B%的關系曲線,由曲線分析,下列判斷正確的是
pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數B%的關系曲線,由曲線分析,下列判斷正確的是

A.T1<T2 p1<p2 m+n>p放熱反應
B.T1>T2 p1<p2 m+n<p吸熱反應
C.T1<T2 p1>p2 m+n>p放熱反應
D.T1>T2 p1<p2 m+n>p吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)與![]() 的變化關系如圖所示。下列說法正確的是( )
的變化關系如圖所示。下列說法正確的是( )
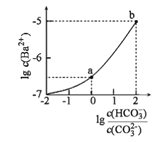
(已知:H2CO3的Ka1、Ka2分別為4.2×10-7、5.6×10-11)
A.a對應溶液的pH小于b
B.b對應溶液的c(H+)=4.2×10-7mol·L-1
C.a→b對應的溶液中![]() 減小
減小
D.a對應的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將V1 mL1.00mol·L-1HCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50mL,下列敘述正確的是( )
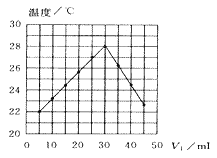
A.做該實驗時環境溫度為22℃
B.該實驗表明化學能可能轉化為熱能
C.NaOH溶液的濃度約為1.00mol·L-1
D.該實驗表明有水生成的反應都是放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.某元素原子核外電子總數是最外層電子數的5倍,則其最高正價為+7
B.鈉元素的第一、第二電離能分別小于鎂元素的第一、第二電離能
C.高氯酸的酸性與氧化性均大于次氯酸的酸性與氧化性
D.鄰羥基苯甲醛的熔點高于對羥基苯甲醛的熔點
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com