
【題目】實驗室里利用以下反應制取少量氮氣:NaNO2+NH4Cl===NaCl+N2↑+2H2O。關于該反應的下列說法正確的是( )
A. 每生成1 mol N2轉移的電子的物質的量為6 mol
B. N2既是氧化劑,又是還原劑
C. NH4Cl中的氮元素被還原
D. NaNO2是氧化劑
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列關于電離平衡常數(K)的說法中正確的是
A. 在一定溫度,相同濃度時電離平衡常數(K)越大可以表示弱電解質電離程度越大
B. 電離平衡常數(K)與溫度無關
C. 不同濃度的同一弱電解質,其電離平衡常數(K)不同
D. 多元弱酸各步電離平衡常數相互關系為K1<K2<K3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質A~F是我們熟悉的單質或化合物,其中A、B均是常見的金屬,且B的合金用量最大;E在常溫下是黃綠色氣體;在適當的條件下,它們之間可以發生如下圖所示的轉化。

試回答下列問題:
⑴ A的化學式是____________;
⑵ 反應F→D的化學方程式是______________________________________。
⑶ 檢驗F中金屬陽離子的常用方法是___________________________________。
⑷ 物質B與鹽酸反應的離子方程式是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學一選修5:有機化學基礎】
有機高分子化合物G的合成路線如下:

已知:
①A既能與NaHCO3溶液反應,又能與FeCl3溶液發生顯色反應,其核磁共振氫譜有4個峰。

請回答:
(1)B的名稱為________,G中含有的官能團名稱為________。
(2)B→C、D→E的反應類型分別為______________、 。
(3)A+E→F的化學方程式為 。
(4)D發生銀鏡反應的化學方程式為 。
(5)符合下列條件的E的同分異構體有________種(不考慮立體異構),寫出其中一種的結構簡式 。
( ①含有![]() 結構 ②苯環上有2個取代基 )
結構 ②苯環上有2個取代基 )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核電荷數由小到大順序排列的五種短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金屬性最強,Q的非金屬性最強;W的單質是淡黃色固體;X、Y、W在周期表中的相對位置關系如圖所示
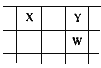
(1)五種元素形成的單質,其中固態時屬于原子晶體的是________(填化學式);常用作強氧化劑的是________、________(填化學式)。
(2)這五種元素中,原子半徑最大的是________(填化學式);由Z、W、Q形成的簡單離子半徑由大到小的順序是________(用化學式表示);X、W、Q的最高價氧化物的水化物酸性從強到弱的順序是________(用化學式表示)。
(3)Y和Z形成的一種化合物中含有離子鍵和共價鍵,請用電子書表示該化合物中化學鍵的形成過程___________________________________。
(4)Z與Q反應生成的化合物屬于________化合物;電解該化合物的飽和溶液,陽極的電極反應式為________;電解一段時間后,將陽極產物和陰極溶液混合,反應的化學方程式是______________。
(5)由X、Y和氫三種元素組成的化合物X6H12Y6,已知:9 g該化合物燃燒放出140 kJ的熱,寫出該化合物燃燒熱的熱化學方程式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科學家利用二氧化鈰(CeO2)在太陽能作用下將H2O、CO2轉變為H2、CO。其過程如下:

下列說法不正確的是
A.該過程中CeO2沒有消耗
B.該過程實現了太陽能向化學能的轉化
C.如圖中△H1=△H2+△H3

D.以CO和O2構成的堿性燃料電池的負極反應式為CO+4OH2e![]()
![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在具有下列電子排布式的原子中,原子半徑最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成分為Al2O3,含Fe2O3雜質)為原料冶煉鋁的工藝流程如下:

下列敘述正確的是( )
A.試劑X可以是氫氧化鈉溶液,也可以是鹽酸
B.反應①過濾后所得沉淀為氫氧化鐵
C.圖中所示轉化反應都不是氧化還原反應
D.反應②的化學方程式為NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用硫鐵礦燒渣(主要成分為Fe3O4、Fe2O3、FeO、SiO2)為原料制備高檔顏料——鐵紅(Fe2O3),具體生產流程如下:

試回答下列問題:
(1)硫鐵礦燒渣用稀硫酸酸溶時的不溶物為 (填化學式)。
(2)實驗室實現“步驟Ⅱ”中分離操作所用的玻璃儀器有 ;
步驟Ⅳ中應選用 試劑調節溶液的pH(填字母編號)。
A.稀硝酸 | B.氫氧化鈉溶液 | C.高錳酸鉀溶液 | D.氨水 |
(3)檢驗步驟Ⅲ已經進行完全的試劑是 。
(4)步驟Ⅴ的反應溫度一般需控制在35℃以下,其目的是 。
(5)步驟Ⅵ在空氣中煅燒發生反應的化學反應方程式為 。
(6)欲測定硫鐵礦燒渣中Fe元素的質量分數,稱取ag樣品,充分“酸溶”、“水溶”后過濾,向濾液中加入足量的H2O2,充分反應后加入NaOH溶液至不再繼續產生沉淀,經過濾、洗滌、灼燒至固體恒重,冷卻后稱得殘留固體bg。
①寫出加入足量的H2O2發生反應的離子反應方程式 ;
②測得該樣品中Fe元素的質量分數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com