
【題目】已知某合金粉末除含鋁外,還含有鐵、銅中的一種或兩種,某興趣小組在老師的指導下,對合金中鐵、銅的存在情況進行了如下探究。
(查閱資料)鐵、銅不與氫氧化鈉溶液反應。
(猜想)猜想1:該合金粉末中,除含鋁外,還含有鐵。
猜想2:該合金粉末中,除含鋁外,還含有銅。
猜想3:該合金粉末中,除含鋁外,還含有_________(填名稱)。
(實驗探究)下列實驗僅供選擇的試劑是:10%的鹽酸、30%的氫氧化鈉溶液。
實驗方案 | 實驗現象 | 結論 |
①取一定量的合金粉末,加過量的____,充分反應后過濾,濾渣備用。 | 粉末部分溶解,并有氣體放出。 | 合金中一定含有鋁。 |
②取步驟①所得濾渣,加過量的______,充分反應。 | 濾渣粉末部分溶解,并有氣體放出,溶液呈現淺綠色。 | 合金中一定含有______。 |
(探究結論)猜想3成立。
(反思)一般來說,活潑金屬能與鹽酸等酸反應,而鋁與酸、堿都能反應,說明鋁具有特殊的性質。寫出鋁與氫氧化鈉溶液反應的離子方程式__________。
(知識延伸)在一定條件下,鐵和鋁都能與水反應。寫出在相應條件下,鐵和水發生反應的化學方程式_______________。
【答案】鐵和銅 30%的氫氧化鈉溶液 10%的鹽酸 鐵和銅 2Al+2H2O+2NaOH=2NaAlO2+H2↑ 3Fe+4H2O![]() Fe3O4+ H2
Fe3O4+ H2
【解析】
金屬鋁和氫氧化鈉反應,鐵銅不與氫氧化鈉反應,通過特征反應得到與氫氧化鈉反應生成氣體的一定含有金屬鋁,和鹽酸反應的一定是金屬鐵,銅不與鹽酸反應,剩余固體是金屬銅。
通過前后聯系,得出該合金粉末中,除含鋁外,還含有鐵和銅;
①取一定量的合金粉末,能說明有Al的有氣泡的,只能是Al和氫氧化鈉反應生氣氣泡;
②取步驟①所得濾渣,加過量的10%的鹽酸,充分反應。有氣泡產生說明合金中一定含有鐵,濾渣沒有全部溶解說明還有金屬銅。
反思:
一般來說,活潑金屬能與鹽酸等酸反應,而鋁與酸、堿都能反應,說明鋁具有特殊的性質。寫出鋁與氫氧化鈉溶液反應的離子方程式2Al+2H2O+2NaOH=2NaAlO2+H2↑。
知識延伸:
鐵和水發生反應的化學方程式3Fe+4H2O(g)![]() Fe3O4+ H2。
Fe3O4+ H2。


科目:高中化學 來源: 題型:
【題目】下列說法不正確的是![]()
![]()
A.煤的氣化就是把煤轉化為可燃性氣體的過程。在高溫下,煤和水蒸氣作用得到CO、![]() 、
、![]() 等氣體
等氣體
B.糖類、油脂、蛋白質在一定條件下均能水解
C.向蛋白質溶液中加入飽和硫酸鈉溶液,先產生白色沉淀,加水后又重新溶解
D.淀粉溶液中滴加硫酸,加熱水解后,往水解液中滴加![]() 滴新制氫氧化銅,加熱,無紅色沉淀出現,原因可能是硫酸未完全被中和
滴新制氫氧化銅,加熱,無紅色沉淀出現,原因可能是硫酸未完全被中和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“硫代硫酸銀”( [ Ag(S2O3)2]3–)常用于切花保鮮,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)現用現配制。某小組探究其配制方法。
(實驗一)

(1)A為Ag2S2O3。寫出生成A的離子方程式__________。
(2)對實驗現象的分析得出,試管a中充分反應后一定生成了__________(填離子符號)。進而推測出沉淀m可能為Ag2S、Ag、S或它們的混合物。做出推測的理由是__________。
(3)若試管a中物質充分反應后不過濾,繼續加入1.1 mL Na2S2O3溶液,振蕩,靜置,黑色沉淀不溶解,清液中逐漸出現乳白色渾濁,有刺激性氣味產生。用離子方程式解釋產生白色渾濁的原因:__________。
結論:Ag2S2O3不穩定,分解所得固體不溶于Na2S2O3溶液。
(實驗二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(無色)
2 [ Ag(S2O3)2]3–(無色)
實驗操作 | 實驗現象 |
i. | 白色沉淀生成,振蕩后迅速溶解,得到無色清液; 滴加至約1 mL時清液開始略顯棕黃色,有丁達爾現象; 超過1.5 mL后,產生少量白色沉淀,立即變為棕黃色,最終變為黑色; 滴加完畢,靜置,得到黑色沉淀,上層清液pH = 5 |
ii. | 白色沉淀生成,立即變為棕黃色,充分振蕩后得到棕黃色清液,有丁達爾現象。 |
(4)用平衡移動原理解釋實驗i中加入1.5 mL AgNO3后產生白色沉淀的原因:__________。
(5)實驗i中,當加入0.5 mL AgNO3溶液時,得到無色清液,若放置一段時間,無明顯變化。結合化學反應速率分析該現象與ii不同的原因是__________。
(6)簡述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制該保鮮劑時,試劑的投料比和操作:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種新型的光化學電源,當光照射N型半導體時,通入O2和H2S即產生穩定的電流并獲得H2O2 (H2AQ和AQ是兩種有機物)。下列說法正確的是

A.甲池中的石墨電極是電池的負極
B.H+通過全氟磺酸膜從甲池進入乙池
C.甲池中石墨電極上發生的電極反應為AQ+2H+-2e-=H2AQ
D.總反應為 H2S + O2![]() H2O2 + S↓
H2O2 + S↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含有Na2O雜質的Na2O2試樣,一個化學實驗小組利用H2O與Na2O2的反應來測定該樣品的純度。可供選擇的裝置如下:

請回答下列問題:
(1)裝置⑤中儀器a的名稱是______。
(2)用上述裝置可以組裝一套最簡單的測定過氧化鈉樣品純度的實驗裝置。
Ⅰ.該實驗裝置的組合是________(填字母)。
a. ①④⑤ b. ①③⑤ c. ②④⑤ d. ③⑤⑥
Ⅱ.所選用裝置的連接順序應是__________(填各接口的字母,連接膠管省略)。
(3)寫出實驗中Na2O2發生反應的化學方程式_____________。
(4)用上述實驗后所得溶液配制成濃度為1.0mol/L的溶液,回答下列問題。
①向400mL該溶液中通入0.3mol CO2,則所得溶液中HCO3–和CO32–的物質的量濃度之比約為___________。
A. 1:3 B. 1:2 C. 2:1 D. 3:1
②將上述溶液蒸發結晶得到Na2CO3和NaHCO3固體混合物,下列選項中不能準確測定混合物中Na2CO3質量分數的是____________。
a. 取a g混合物充分加熱,在干燥器中冷卻至室溫,減重b g
b. 取a g混合物與足量稀鹽酸充分反應,加熱、蒸干、灼燒,得b g固體
c. 取a g混合物與足量稀硫酸充分反應,逸出氣體用堿石灰吸收,增重b g
d. 取a g混合物與足量Ba(OH)2溶液充分反應,過濾、洗滌、烘干,得b g固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化尿素[CO(NH2)2·H2O2]是一種漂白、消毒、增氧劑,常溫下為白色晶體,易于貯運,一般條件下不易分解,可用30%的雙氧水和飽和尿素溶液在一定條件下來合成。
實驗原理:CO(NH2)2+H2O2![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
實驗裝置:實驗室模擬制取裝置如圖1所示(部分儀器未畫出)。
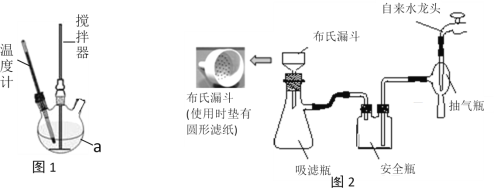
實驗步驟:
步驟一:在250mL的儀器a中加入100mL30%的過氧化氫溶液,再加1 g NaH2PO4作穩定劑,開啟攪拌器,通過儀器a右端瓶口緩慢加入50 g尿素,全部溶解后,控制溫度在30℃左右,攪拌反應30分鐘。
步驟二:將儀器a中的溶液用普通漏斗過濾,將濾液冷卻到0℃,析出大量晶體,抽濾,烘干即得產品。
回答下列問題:
(1)儀器a 的名稱是____________,制取過程中需控制n(H2O2):n[CO(NH2)2] =1.2 :1左右,并控制合成溫度在30℃左右,其主要原因是__________________________________,控制反應溫度的加熱方法是________________。
(2)實驗室一般用玻璃而非鐵質攪拌器的原因是____________________________________。而實際生產中攪拌器選用的是鐵質材料,但需將攪拌裝置放在__________________(填試劑名稱)中浸泡一段時間,使其表面鈍化。
(3)①步驟二中“抽濾”按圖2安裝好裝置,在布氏漏斗中放入濾紙,接下來的操作順序是____________________→確認抽干(填標號)
a. 轉移固液混合物 b. 開大水龍頭 c. 微開水龍頭 d. 加入少量蒸餾水潤濕濾紙
②與用普通漏斗過濾相比,抽濾的主要優點是______________________________。
(4)過氧化尿素鑒定反應:在重鉻酸鉀酸性溶液中加入乙醚和少許過氧化尿素,振蕩。上層乙醚呈藍色,這是由于在酸性溶液中過氧化尿素中的過氧化氫與重鉻酸鉀反應生成較穩定的藍色過氧化鉻(CrO5:![]() ),重鉻酸鉀與H2O2反應的離子方程式為_______________。
),重鉻酸鉀與H2O2反應的離子方程式為_______________。
(5)過氧化尿素的合格產品中H2O2 的質量分數應不低于34%。為了確定某次實驗產品合格與否,稱取了該次樣品12.0000g,溶于水配制成250mL溶液。移取25.00mL溶液于錐形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4標準溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液與尿素不反應)。終點顏色變化為_____________。根據滴定結果通過計算判斷該次實驗產品質量為___________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重要的農藥、醫藥中間體-堿式氯化銅[CuaClb(OH)c·xH2O],可以通過以下步驟制備。步驟 1:將銅粉加入稀鹽酸中,并持續通空氣反應生成 CuCl2。已知Fe3+對該反應有催化作用,其催化原理如圖所示。步驟2:在制得的CuCl2溶液中,加入石 灰乳充分反應后即可制備堿式氯化銅。下列有關說法不正確的是

A.圖中M、N分別為Fe2+、Fe3+
B.a、b、c 之間的關系式為:2a=b+c
C.步驟1充分反應后,加入少量CuO是為了除去Fe3+
D.若制備1 mol的CuCl2,理論上消耗標況下11.2 LO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由反應物 X 轉化為 Y 或 Z 的能量變化如圖所示。下列說法正確的是

A.由 X→Y 反應的 ΔH=E5-E2
B.由 X→Z 反應的 ΔH=E2-E1
C.反應 2X(g)=3Y(g)的活化能=E3-E2
D.2X(g)=Z(s) ΔH<(E1-E2) kJ·molˉ1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼(B)鈷(Co)和錳(Mn)形成物質時比較復雜和變化多端。
(1) Co基態原子核外電子排布式為_________,第二周期元素第一電離能比B高的有______種;
(2)硝酸錳是工業制備中常用的催化劑,Mn(NO3)2中的化學鍵除了σ鍵外,還存在______;
(3)NaBO2可用于織物漂白。BO2-的空間構型為_______寫出兩種與其互為等電子體的分子的化學式:_______;
(4)下圖表示偏硼酸根的一種無限長的鏈式結構,其化學式可表示為____(以n表示硼原子的個數);

下圖表示的是一種五硼酸根離子, 其中B原子的雜化方式為________;

(5)立方BN和立方AIN均為原子晶體,結構相似,BN的熔點高于AIN的原因為_______________;
(6)一種新型輕質儲氫材料的晶胞結構如下圖所示,設阿伏加德羅常數的值為NA,該晶體的密度為__gcm-3(用含a、NA的代數式表示)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com