
【題目】R、W、X、Y、M是原子序數依次增大的五種短周期主族元素。R最常見同位素的原子核中不含中子。W與X可形成兩種穩定的化合物:WX和WX2。工業革命以來,人類使用的化石燃料在燃燒過程中將大量WX2排入大氣,在一定程度導致地球表面平均溫度升高。Y與 X 是同一主族的元素,且在元素周期表中與X相鄰。
(1)W的原子結構示意圖是_______________。
(2)WX2的電子式是________________。
(3)R2X、R2Y中,穩定性較高的是___________(填化學式),請從原子結構的角度解釋其原因:_____________________。
(4)Se與Y是同一主族的元素,且在元素周期表中與Y相鄰。
①根據元素周期律,下列推斷正確的是___________填字母序號)。
a.Se的最高正化合價為+7價
b.H2Se的還原性比H2Y強
c.H2SeO3的酸性比H2YO4強
d.SeO2在一定條件下可與NaOH溶液反應
②室溫下向SeO2固體表面吹入NH3,可得到兩種單質和H2O,該反應的化學方程式為_______。
【答案】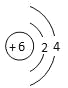
![]() H2O O與S為同主族元素,O的電子層數小于S,O的原子半徑小于S,O的原子核對核外電子吸引能力大于S原子,O的非金屬性強于S,故H2O的穩定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
H2O O與S為同主族元素,O的電子層數小于S,O的原子半徑小于S,O的原子核對核外電子吸引能力大于S原子,O的非金屬性強于S,故H2O的穩定性大于 H2S。 bd 3SeO2+ 4NH3=3Se + 2N2+ 6H2O
【解析】
R、W、X、Y、M是原子序數依次增大的五種短周期主族元素。R最常見同位素的原子核中不含中子,R為H元素;W與X可形成兩種穩定的化合物:WX和WX2,工業革命以來,人類使用的化石燃料在燃燒過程中將大量WX2排入大氣,在一定程度導致地球表面平均溫度升高,則W為C元素、X為O元素;Y與X是同一主族的元素,且在元素周期表中與X相鄰,Y為S元素;M的原子序數最大,M為Cl元素,據此分析解答。
由上述分析可知,R、W、X、Y、M五種短周期主族元素分別為H、C、O、S、Cl。
(1)C的原子結構示意圖是![]() ,故答案為:
,故答案為:![]() ;
;
(2)WX2為CO2,電子式為![]() ,故答案為:
,故答案為:![]() ;
;
(3)R2X、R2Y分別為H2O和H2S,O與S為同主族元素,O的電子層數小于S,O的原子半徑小于S,O的原子核對核外電子吸引能力大于S原子,O的非金屬性強于S,故H2O的穩定性大于H2S,穩定性較高的是H2O,故答案為:H2O;O與S為同主族元素,O的電子層數小于S,O的原子半徑小于S,O的原子核對核外電子吸引能力大于S原子,O的非金屬性強于S,故H2O的穩定性大于H2S;
(4)①a.Se的最外層電子數為6,最高正化合價為+6價,故a錯誤;b.非金屬性S大于Se,則H2Se的還原性比H2S強,故b正確;c.H2SeO3為弱酸,H2SO4為強酸,故c錯誤;d.SeO2為酸性氧化物,一定條件下可與NaOH溶液反應生成鹽和水,故d正確;故答案為:bd;
②室溫下向SeO2固體表面吹入NH3,可得到兩種單質和H2O,該反應的化學方程式為3SeO2+4NH3═3Se+2N2+6H2O,故答案為:3SeO2+4NH3═3Se+2N2+6H2O。


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案科目:高中化學 來源: 題型:
【題目】運用有關概念判斷下列敘述正確的是
A.堿性氧化物都是金屬氧化物,有些金屬氧化物是酸性氧化物
B.Na2SO3能被Fe3+、H2O2、濃硝酸、濃硫酸、氯氣等氧化劑氧化
C.![]() 互為同系物
互為同系物
D.BaSO4的水溶液不易導電,其電離方程式為BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 均為原子序數小于18的常見元素,且原子序數依次增大。已知
均為原子序數小于18的常見元素,且原子序數依次增大。已知![]() 原子最外層電子數與核外電子總數之比為
原子最外層電子數與核外電子總數之比為![]() ,
,![]() 原子的最外層電子數與次外層電子數之比為
原子的最外層電子數與次外層電子數之比為![]() ;
;![]() 比
比![]() 的原子序數小1;
的原子序數小1;![]() 與
與![]() 的電子層結構相同;化合物
的電子層結構相同;化合物![]() 在常溫下為氣體。請回答下列問題:
在常溫下為氣體。請回答下列問題:
(1)寫出![]() 的簡單離子的結構示意圖:______。
的簡單離子的結構示意圖:______。
(2)由![]() 、
、![]() 、
、![]() 三種元素形成的鹽的化學式為____________。
三種元素形成的鹽的化學式為____________。
(3)![]() 與
與![]() 可形成2種分子,分別為10電子和18電子的分子,寫出該18電子分子轉化成10電子分子的化學方程式:____________。
可形成2種分子,分別為10電子和18電子的分子,寫出該18電子分子轉化成10電子分子的化學方程式:____________。
(4)寫出![]() 的單質的一種工業用途:____________。
的單質的一種工業用途:____________。
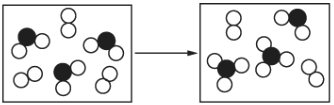
(5)如圖表示由上述元素中的某兩種元素組成的氣體分子在密閉容器中,一定條件下充分反應前后的轉化關系,該轉化過程的化學方程式為____________。
(6)![]() 是由
是由![]() 、
、![]() 、
、![]() 、
、![]() 四種元素組成的一種化合物,已知
四種元素組成的一種化合物,已知![]() 既能與鹽酸反應,又能與
既能與鹽酸反應,又能與![]() 溶液反應,還能和氯水反應,寫出
溶液反應,還能和氯水反應,寫出![]() 與氯水反應的離子方程式:__________________。
與氯水反應的離子方程式:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知短周期主族元素X、Y、Z、W的原子序數依次增大,X元素原子的最外層電子數是內層電子數的3倍,Y與X能形成兩種化合物,Z所在的周期序數與族序數相同。下列說法正確的是( )
A.Y的單質能從Z的鹽溶液中置換出Z
B.簡單氫化物的熱穩定性:![]()
C.Z與X兩元素不能形成陰離子
D.簡單離子的半徑大小:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為四種常見元素,其中X、Y、Z為短周期元素。有關信息如表所示.
原子或分子相關信息 | 單質或化合物相關信息 | |
X |
| X的最高價氧化物對應的水化物為無機酸中的最強酸 |
Y | Y原子的最外層電子數等于電子層數 | Y的氧化物是典型的兩性氧化物,可用于制造一種極有前途的高溫材料 |
Z | Z原子的最外層電子數是次外層電子數的 | Z是無機非金屬材料的主角,其單質是制取大規模集成電路的主要原料 |
W | W原子的最外層電子數小于4 | W的常見化合價有 |
(1)W在周期表中的位置為______,![]() 在空氣中不穩定,極易被氧化,由白色迅速變成灰綠色,最后變成紅褐色,反應的化學方程式為______
在空氣中不穩定,極易被氧化,由白色迅速變成灰綠色,最后變成紅褐色,反應的化學方程式為______
(2)X的簡單陰離子的結構示意圖為______,X的最高價氧化物對應水化物的水溶液與Y的氧化物反應的離子方程式為________
(3)Z的氧化物在通訊領域用來作______,工業上制備Z的單質的化學反應方程式為______。鍺與Z是同一主族元素,它可用來制造半導體品體管.研究表明:有機鍺具有明顯的抗腫瘤活性,鍺不與![]() 溶液反應但在有
溶液反應但在有![]() 存在時可與
存在時可與![]() 溶液反應生成鍺酸鹽,反應的化學方程式為_______
溶液反應生成鍺酸鹽,反應的化學方程式為_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半徑和化合價信息如下表所示:
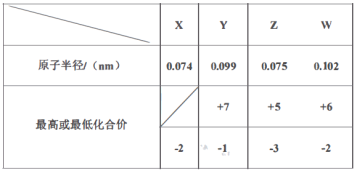
M的焰色反應為黃色:X、Y、R位于周期表中不同周期;Q的單質為半導體材料。
(1)Q元素在周期表中的位置是___;構成化合物M2X2的化學鍵類型是___。
(2)寫出X、Y、R按原子個數之比為1:1:1形成的化合物的電子式___。
(3)Y與W相比,非金屬性較強的是___(用元素符號表示),下列事實能證明這一結論的是___(選填字母序號)。
a.常溫下W的單質呈固態,Y的單質呈氣態
b.Y與W形成的化合物中W呈正價
c.Y和M反應時,lmolY原子所得電子數少于lmolW原子所得電子數
(4)R、W兩種元素組成的離子在水溶液中與H+和OH-都不能大量共存,還能與氯水反應,寫出其與新制氯水反應的離子方程式___。
(5)Z2R4為二元弱堿,在水中的電離與氨相似,寫出其在水中的第一步電離方程式___,Z2R4與磷酸形成的磷酸二氫鹽的化學式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是應用廣泛的金屬,以鋁土礦(主要成分為A12O3,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如圖:

已知:SiO2在“堿溶”時轉化為鋁硅酸鈉沉淀。
(1)“堿溶”時生成偏鋁酸鈉的離子方程式為__。
(2)“濾渣Ⅰ”的成分有___。
(3)向“過濾Ⅰ”所得濾液中通入足量的CO2,反應的離子方程式為___。
(4)“濾液Ⅱ”中加入足量的CaO,生成的__(填化學式)可循環利用。
(5)“灼燒”的化學方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素周期律的敘述正確的是( )
A.隨著元素原子序數的遞增,原子最外層電子數從1到8(第1周期元素及過渡元素除外)重復出現
B.隨著元素原子序數的遞增,元素最高正化合價從+1到+7、負化合價從-7到-1重復出現
C.隨著元素原子序數的遞增,原子(稀有氣體元素原子除外)半徑從小到大發生周期性變化
D.元素性質的周期性變化是元素原子核外電子排布周期性變化的必然結果
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】AG 定義為 AG= lg![]() ,若用 AG 來表示溶液的酸度,說法不正確的是
,若用 AG 來表示溶液的酸度,說法不正確的是
A.在一定溫度下,溶液的酸性越強,AG 越大
B.65℃時,pH 與 AG 的換算公式為 AG = 2 (7 – pH)
C.若溶液顯堿性,則 AG < 0
D.若溶液顯中性,則 AG = 0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com