
【題目】實驗室常用濃硫酸和乙醇混合加熱制取乙烯,下列說法正確的個數是( )
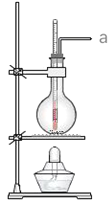
①濃硫酸只作催化劑
②在反應容器中放入幾片碎瓷片防止混合液暴沸
③反應溫度緩慢上升至170℃
④用排水法或向下排氣法收集乙烯
⑤圓底燒瓶中裝的是4mL乙醇和12mL3mol/LH2SO4混合液
⑥溫度計應插入反應溶液液面下,以便控制溫度
⑦反應完畢后先熄滅酒精燈,再從水中取出導管
⑧該反應類型屬于取代反應
⑨若a口出來的氣體使溴水褪色,說明有乙烯生成
A.1B.2C.3D.4
【答案】B
【解析】
①在反應中濃硫酸既是脫水劑,又是催化劑,①錯誤;
②為防止混合液暴沸,在反應容器中放入幾片碎瓷片,②正確;
③140℃時反應生成乙醚,為防副反應的發生,反應溫度應迅速上升至170℃,③錯誤;
④乙烯的密度與空氣差不多,只能用排水法收集乙烯,不能用排空氣法收集,④錯誤;
⑤用乙醇和濃硫酸混合加熱制乙烯,⑤錯誤;
⑥溫度計測反應溶液的溫度,應插入反應溶液液面下,以便控制溫度,⑥正確;
⑦為防止倒吸,反應完畢后先從水中取出導管,再熄滅酒精燈,⑦錯誤;
⑧乙醇制乙烯,反應類型屬于消去反應,⑧錯誤;
⑨在反應過程中,濃硫酸易被乙醇還原為二氧化硫,則a口出來的氣體使溴水褪色,無法說明有乙烯生成,⑨錯誤。
從以上分析可知,②⑥正確,故選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在容積為V的密閉容器中發生可逆反應![]() ?
?![]() ?
?![]() ,下列說法正確的是( )
,下列說法正確的是( )
A.若A為氣態,則氣體的平均密度不再變化時反應達到平衡狀態
B.升高溫度,C的體積分數增大,則該反應正方向放熱
C.達到平衡后,向容器中加入B,正反應速率一定增大
D.達到平衡后,若將容器的容積壓縮為原來的一半,C的濃度變為原來的![]() 倍,則A一定為非氣態
倍,則A一定為非氣態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于價電子構型為4s24p4的基態原子描述正確的是( )
A. 它的元素名稱為錫 B. 它的核外電子排布式為[Ar]4s24p4
C. 它的第一電離能小于As D. 其外圍電子排布圖為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,20mL某氣態烴與過量氧氣混合,將完全燃燒后的產物通過濃硫酸,再恢復至室溫,氣體體積減少了50mL,將剩余氣體再通過氫氧化鈉溶液,體積又減少了40mL,求該氣態烴的分子式( )
A.CH4B.C2H6C.C2H4D.C2H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃燒ag液態乙醇生成二氧化碳氣體和液態水,放出QkJ熱量,經測定ag液態乙醇與足量鈉 反應生成標準狀況下5.6L氫氣。則液態乙醇燃燒的熱化學方程式表示正確的是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-QkJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-2QkJ·mol-1
C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=+QkJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置或操作能達到實驗目的的是
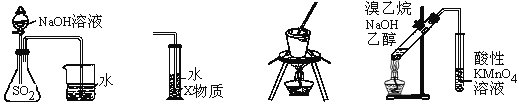
① ② ③ ④
A. 裝置①可用于證明SO2與NaOH溶液發生了反應
B. 若裝置②中X為CCl4,可用于吸收氨氣或氯化氫
C. 裝置③可用于實驗室從食鹽水中提取氯化鈉
D. 裝置④可用于證明溴乙烷與NaOH乙醇溶液共熱生成乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,不能達到實驗目的是( )
A. 圖1:實驗室制備Fe(OH)2
圖1:實驗室制備Fe(OH)2
B. 圖2:收集NO氣體
圖2:收集NO氣體
C.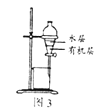 圖3:所示裝置分離CCl4萃取溴水后已分層的有機層和水層
圖3:所示裝置分離CCl4萃取溴水后已分層的有機層和水層
D. 圖4:可證明NH4NO3溶解時需要吸收熱量
圖4:可證明NH4NO3溶解時需要吸收熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液。按圖連接裝置,用酒精燈對燒瓶B加熱,當觀察到D中有明顯現象時停止實驗。試完成下列問題:
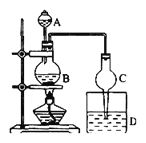
(1)濃硫酸的作用是________________。
(2)球形干燥管除起冷凝作用外,另一重要作用是___________。
(3)裝置D中飽和碳酸鈉溶液的作用是_____________。
(4)裝置B中反應的化學方程式:_______。
(5)實驗完成后利用________________方法分離出粗產品;粗產品往往含有少量的水,精制的方法是向粗產品中加入_________________后再利用_________________方法提純。
查看答案和解析>>
科目:高中化學 來源: 題型:
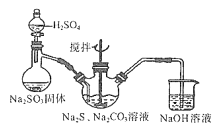
【題目】硫代硫酸鈉俗稱保險粉,可用于照相業作定影劑、紙漿漂白作脫氯劑等。實驗室用SO2通入Na2S和Na2CO3的混合溶液中來制備硫代硫酸鈉。本實驗對Na2S純度要求較高,利用項圖所示的裝置可將工業級的Na2S提純。已知Na2S常溫下微溶于酒精,加熱時溶解度迅速增大,雜質不溶于酒精。提純過程為:將已稱量好的工業級Na2S放入圓底燒瓶中,加入一定質量的酒精和少量水。按下圖所示裝配所需儀器,向冷凝管通入冷卻水,同時水浴加熱。待燒瓶中固體不再減少時,停止加熱。將燒瓶取下,立即趁熱過濾,再冷卻結晶,過濾。將所得固體洗滌、干燥,得到Na2S9H2O晶體。

(1)下列說法不正確的是______。
A.將晶體轉移至布氏漏斗時,若器壁上粘有少量晶體,應用冷水淋洗
B.抽濾時,為防止濾紙穿孔,可適當關小水龍頭或多加一層濾紙
C.洗滌時,可用一定濃度的乙醇溶液洗滌晶體,目的是洗除晶體表面的雜質,易于得到干燥晶體
D.為加快產品的干燥,可高溫烘干
E.在提純過程中“趁熱過濾”操作的目的是防止硫化鈉結晶析岀而損失、去除雜質
(2)用下圖所示裝置制取Na2S2O3,其中盛放Na2SO3固體的玻璃儀器名稱是______,三頸燒瓶中發生反應的化學方程式______。
(3)保險粉樣品中Na2S2O35H2O的純度(質量分數)可通過氧化還原滴定法測定,相關反應方程式為2Na2S2O3+I2=2NaI+Na2S4O6,準確稱取Wg樣品于錐形瓶中,用適量蒸餾水溶解,并滴加淀粉溶液作指示劑。用0.1000mol/L碘的標準溶液進行滴定。請回答:
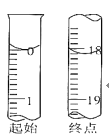
①到達滴定終點的標志______;
②滴定起始和終點的液面位置如圖,則消耗碘的標準溶液體積為______,產品的純度為______(設Na2S2O35H2O相對分子質量為M)。
③若滴定時振蕩不充分,剛看到溶液局部變色就停止滴定,則會使樣品中Na2S2O35H2O的純度的測量結果______(“偏高”、“偏低”或“不變”)。
(4)某研究小組以硫代硫酸鈉與硫酸反應來探究外界條件對反應速率的影響,設計實驗如下:
實驗 編號 | 實驗溫度 /℃ | Na2S2O3 | H2SO4 | 蒸餾水體積 /mL | ||
體積/mL | 濃度/mol/L | 體積/mL | 濃度/mol/L | |||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
下列有關說法不正確的是______。
A.該同學在實驗中采用的研究方法是實驗比較法
B.實驗①和②探究其他條件不變時Na2S2O3濃度對相關反應速率的影響
C. 實驗①和③溶液變渾濁的時間相同
D.其他條件不變時,探究溫度對化學反應速率的影響,應選擇實驗③和實驗⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com