
【題目】下列有關熱化學方程式及其敘述正確的是( )
A.氫氣的燃燒熱為285.5 kJmol-1,則水電解的熱化學方程式為:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃燒生成CO2 (g)和H2O(l)時放出890kJ熱量,它的熱化學方程式為 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,則C的燃燒熱為110.5 kJmol-1
H=-221kJmol-1,則C的燃燒熱為110.5 kJmol-1
D.HF與NaOH溶液反應:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
【答案】B
【解析】
A. 氫氣燃燒熱是放熱反應,焓變為負值,水電解過程是吸熱反應,電解2mol水要消耗的能量為571.0 kJ,A項錯誤;
B. 1mol CH4完全燃燒生成CO2和H2O(l)時放出890kJ熱量,1/2mol甲烷完全燃燒生成二氧化碳和液態水放熱445kJ,熱化學方程式為:1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1,B項正確;
H=-445kJmol-1,B項正確;
C. 選項中反應生成的一氧化碳不是穩定氧化物,該反應熱不是燃燒熱,C項錯誤;
D. HF是弱酸,存在電離平衡,電離過程是吸熱過程,熱化學方程式中不能拆成離子,且1mol NaOH溶液與HF溶液反應放熱小于57.3kJ,D項錯誤;
答案選B。


科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一新型高效無毒的多功能水處理劑。資料:K2FeO4為紫色固體,微溶于KOH溶液,具有強氧化性,在酸性或中性溶液中快速產生O2,在堿性溶液中較穩定。
(1)制備K2FeO4
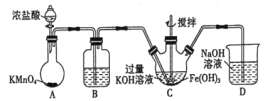
①寫出A中發生反應的化學方程式______。
②除雜裝置B中的試劑為____。
③C為制備K2FeO4裝置,KOH溶液過量的原因是____。
④D為尾氣處理裝置,發生反應的離子方程式為____。
(2)探究K2FeO4的性質取C中紫色溶液,加入稀硫酸,產生黃綠色氣體,得溶液a,經檢驗氣體中含有Cl2。為證明K2FeO4能否氧化Cl而產生Cl2設計以下方案:
方案Ⅰ | 取少量溶液a,滴加KSCN溶液至過量,溶液呈紅色 |
方案Ⅱ | 用KOH溶液充分洗滌C中所得固體,再用KOH溶液將K2FeO4溶出,得到紫色溶液b。取少量b,滴加鹽酸,有Cl2產生 |
①由方案Ⅰ中溶液變紅可知a中含有____。該離子的產生__(填“能”或“不能”)判斷一定是由K2FeO4被Cl還原而形成的。
②方案Ⅱ用KOH溶液洗滌的目的是____,方案Ⅱ得出氧化性:Cl2 ___FeO42(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的化合物在生產生活中廣泛存在。請回答:
(1)催化轉化器可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應, 生成無毒物質,減少汽車尾氣污染。
已知:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2= -221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) △H3= -393.5 kJ·mol-1
計算尾氣轉化反應 2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=_____。
(2)NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。反應的熱化學方程式為:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反應在2L 密閉容器中進行,在其它條件相同時,使用不同的催化劑 A、B、C,產生 N2 的物質的量隨時間變化如圖 1 所示。
5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反應在2L 密閉容器中進行,在其它條件相同時,使用不同的催化劑 A、B、C,產生 N2 的物質的量隨時間變化如圖 1 所示。

圖1 圖2
①下列有關說法正確的是__________________________________。
A. 反應在任何溫度下均可自發進行
B. 50 s 在催化劑A 作用下,平均反應速率v(N2)=2.5×10-2mol·L-1·s-1
C. 用催化劑C 達到平衡時,N2 產率最小
D. 分離出反應體系中的H2O(g)有利于氮氧化物的脫除
E. 相同條件下,若使用催化劑 B,使逆反應速率加快 100 倍,使用催化劑 C,使正反應速率加快 65 倍,則應該選用催化劑 B
②在催化劑A 的作用下,經過相同時間,測得脫氮率隨反應溫度的變化情況如圖 2 所示,據圖可知,在相同的時間內,300℃之前,溫度升高脫氮率逐漸增大,300℃之后溫度升高脫氮率逐漸減小(假設催化劑活性不受影響),寫出脫氮率隨溫度變化的原因__________________________。
③其他條件相同時,請在圖 2 中補充在催化劑B 作用下脫氮率隨溫度變化的曲線。__________________________________________________________
(3)以連二硫酸根(S2O42-)為媒介,使用間接電化學法也可處理燃煤煙氣中的 NO,裝置如圖所示
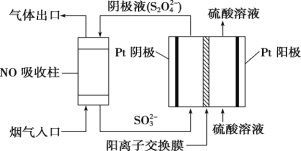
① 陰極區的電極反應式為___________________________________________ 。
② 通電時,當電路中轉移 0.2mol e-,可吸收的 NO 在標準狀況下的體積為 896mL。則 NO轉化后的產物為_____________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖是化學課外活動小組設計的用化學電源使LED燈發光的裝置示意圖。下列有關該裝置的說法正確的是( )

A. 銅片為負極,其附近的溶液變藍,溶液中有Cu2+產生
B. 如果將鋅片換成鐵片,電路中的電流方向將改變
C. 其能量轉化的形式主要是“化學能→電能→光能”
D. 如果將稀硫酸換成檸檬汁,LED燈將不會發光
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】扁桃酸衍生物是重要的醫藥中間體,以A和B 為原料合成扁桃酸衍生物F路線如下:
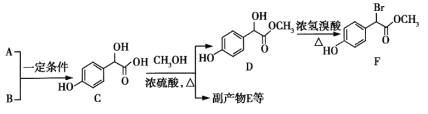
(1)A的分子式為C2H2O3,可發生銀鏡反應,且具有酸性,A所含官能團名稱為:_________。寫出A+B→C的化學反應方程式__________________________。
(2)C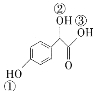 中①、②、③3個—OH的酸性由強到弱的順序是:_______。
中①、②、③3個—OH的酸性由強到弱的順序是:_______。
(3)E是由2分子C生成的含有3個六元環的化合物,E的分子中不同化學環境的氫原子有_____種。
(4)D→F的反應類型是______,1mol F在一定條件下與足量NaOH溶液反應,最多消耗NaOH的物質的量為_______mol。寫出符合下列條件的F的所有同分異構體(不考慮立體異構)的結構簡式____。
①屬于一元酸類化合物 ②苯環上只有2個取代基且處于對位,其中一個是羥基
(5)已知:![]() 。A有多種合成方法,在方框中寫出由乙酸合成A的路線流程圖(其他原料任選)合成路線流程圖示例如下:
。A有多種合成方法,在方框中寫出由乙酸合成A的路線流程圖(其他原料任選)合成路線流程圖示例如下:
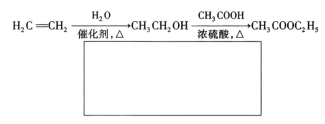
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 烷烴的通式為CnH2n+2,隨n值增大,碳元素的質量百分含量逐漸減小
B. 乙烯與溴加成反應的產物為溴乙烷
C. 1 mol苯恰好與3 mol氫氣完全加成,說明苯分子中有三個碳碳雙鍵
D. n=7,主鏈上有5個碳原子的烷烴共有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻。
(1)將純鋅片和純銅片按圖方式插入100 mL相同濃度的稀硫酸中一段時間,回答下列問題:

①下列說法正確的是__________。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.兩燒杯中溶液的 pH 均增大
②在相同時間內, 兩燒杯中產生氣泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③請寫出圖中構成原電池的負極電極反應式: ____________。
④當甲中溶液質量增重 31.5 克時,電極上轉移電子數目為______。
(2)圖丙為甲烷氧氣燃料電池的構造示意圖,電解質溶液的溶質是 KOH。通甲烷一極的電極反應方程式為 ______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲班學生做完實驗室制備氧氣和還原金屬氧化物的實驗后,剩余物質倒入同一廢液缸里。乙班課外興趣小組同學進行了如圖所示的探究。請回答:
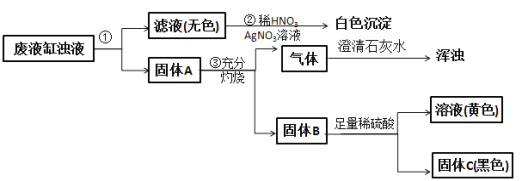
(1)步驟①的操作名稱是___________,所用到的玻璃儀器有漏斗、玻璃棒和___________。
(2)由步驟②實驗現象推知,甲班同學制取氧氣所用的固體反應物是___________(寫化學式)。
(3)由步驟④所得溶液加入氫氧化鈉可得紅棕色沉淀,該反應的化學方程式為______________________。
(4)由步驟③產生的氣體判斷固體A中一定含有___________(寫名稱);綜合步驟③④現象推理,固體A中還可能含有的物質是______________________(寫至少兩種物質的化學式)。
(5)根據上述實驗和分析判斷固體C是___________(寫化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com