
【題目】處于平衡狀態的反應:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改變其他條件的情況下,下列敘述正確的是( )
2H2(g)+S2(g) ΔH>0,不改變其他條件的情況下,下列敘述正確的是( )
A.加入催化劑,反應途徑將發生改變,ΔH也將隨之改變
B.升高溫度,正、逆反應速率都增大,H2S分解率也增大
C.增大壓強,平衡向逆反應方向移動,將引起體系溫度降低
D.若體系恒容,注入一些H2后達新平衡,H2的濃度將減小
【答案】B
【解析】
A. 加入催化劑,反應速率加快,反應的活化能降低;
B. 升高溫度,反應速率加快,平衡向吸熱的方向移動;
C. 增大壓強,平衡向體積縮小的方向移動;
D. 增大生成物的濃度,平衡移向移動。
A.加入催化劑,反應途徑將發生改變,但根據蓋斯定律反應的始態和終態不變,反應的ΔH不會改變,A項錯誤;
B.升高溫度,正逆反應速率都增大,平衡向吸熱反應方向移動,所以平衡正向移動,H2S分解率增大,B項正確;
C.該反應隨反應進行氣體分子數增多,增大壓強,化學平衡逆向移動,由于正反應吸熱,所以平衡逆向移動體系溫度升高,C項錯誤;
D.恒容體系中充入H2平衡逆向移動,但平衡移動的趨勢是很微弱的,只能減弱這種改變,不能抵消這種改變,因此再次平衡時H2的濃度比原來的大,D項錯誤;
答案選B。


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案 小學期末標準試卷系列答案
小學期末標準試卷系列答案科目:高中化學 來源: 題型:
【題目】下表中的各組物質之間通過一步反應就能實現如圖所示轉化的是( )
編號 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】與50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物質的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黑色粉末A,黃色粉末B,它們都是單質,按下圖進行實驗:
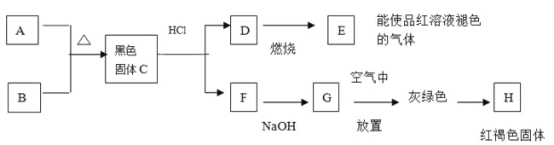
(1) 試根據上述反應現象推斷以下物質的化學式:
A D E H
(2)寫出C+鹽酸![]() D+F的離子方程式:
D+F的離子方程式:
(3)寫出D![]() E的化學方程式:
E的化學方程式:
(4)寫出G![]() H的化學方程式:
H的化學方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定質量的鎂、鋁混合物投到2 mol·L-1的鹽酸中,待金屬完全溶解后,向溶液中加入2 mol·L-1的氫氧化鈉溶液,生成沉淀的質量與加入氫氧化鈉溶液的體積關系如圖所示。則:
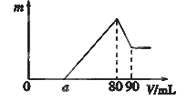
(1)80-90ml對應反應的離子方程式_____________;
(2)金屬鋁的質量為____________g;
(3)鹽酸的體積是____________mL;
(4)a的取值范圍是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食鹽是日常生活的必需品,也是重要的化工原料。粗食鹽中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42—等雜質離子,實驗室提純NaCl的流程如下:
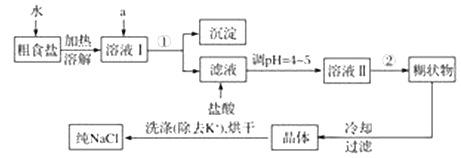
提供的試劑:飽和Na2CO3溶液、飽和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在過濾過程中所需要的玻璃儀器有________________________________________。
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,選出a所代表的試劑,按滴加順序依次為_______(只填化學式)。
(3)用于沉淀的試劑需過量,否則不能將雜質除盡,檢驗過濾的濾液中是否含有Fe3+的方法__________,過濾所得沉淀需要洗滌,洗滌沉淀的方法__________________。
(4)用提純的NaCl配制成480ml 0.2molL-1的NaCl溶液,用托盤天平稱取___________ g純的NaCl晶體,用蒸餾水在_______________中溶解,完全溶解后,全部轉移至________________中,加蒸餾水至______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A(g)+3B(g)![]() 2C(g)+2D(g)在四種不同情況下的反應速率如下,其中表示反應速率最快的是( )
2C(g)+2D(g)在四種不同情況下的反應速率如下,其中表示反應速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀銅合金廣泛應用于航空工業。從銀銅合金的切割廢料中回收銀和制備CuAlO2的流程
如下。
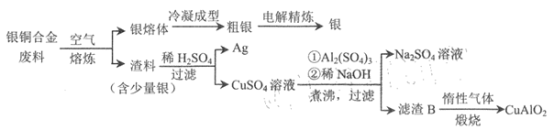
已知:Al(OH) 3和Cu(OH) 2開始分解的溫度分別為450℃和 80℃。 下列說法錯誤的是
A.電解精煉時,粗銀做陽極,純銀做陰極
B.為提高原料利用率,流程中應加過量的稀NaOH
C.濾渣B煅燒時發生的反應為 4CuO+4Al(OH)3![]() 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 銀銅合金(銅的質量分數為64%) 最多可生成 10.0mol CuA1O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等。
已知:①CuCl可以由CuCl2用適當的還原劑如SO2,SnCl2等還原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子:  。
。
請回答下列問題:
(1)基態Cu原子的核外電子排布式為_____;H、N、O三種元素的電負性由大到小的順序是____。
(2)SO2分子的空間構型為________;與SnCl4互為等電子體的一種離子的化學式為________。
(3)乙二胺分子中氮原子軌道的雜化類型為________。乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高得多,原因是__________。
(4)②中所形成的配離子中含有的化學鍵類型有______(填字母)。
A.配位鍵 B.極性鍵 C.離子鍵 D.非極性鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com