
【題目】![]() 可用于治療甲狀腺疾病,其同位素原子可能
可用于治療甲狀腺疾病,其同位素原子可能
A. 質子數為78,中子數為53B. 質子數為54,中子數為131
C. 質子數為53,質量數為127D. 質子數為78,質量數為131
【答案】C
【解析】
![]() 可用于治療甲狀腺疾病,其同位素原子可能
可用于治療甲狀腺疾病,其同位素原子可能
A. 質子數為78,中子數為53 B. 質子數為54,中子數為131
C. 質子數為53,質量數為127 D. 質子數為78,質量數為131
中含有質子數為53,質量數為131,則中子數為131-53=78,質子數相同,中子數不同的同一類原子,互為同位素,由此判斷。
A. 質子數為78,中子數為53,與碘不是同一種素,故A錯誤;
B. 質子數為54,中子數為131,與碘不是同一種素,故B錯誤;
C. 質子數為53,質量數為127,中子數為74,二者都是核素,質子數相同,中子數不同,互為同位素,故C正確;
D. 質子數為78,質量數為131,與碘不是同一種素,故D錯誤;
故選C。


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:
【題目】將如圖所示實驗裝置的K閉合,下列判斷正確的是

A. Cu電極上發生還原反應
B. 電子沿Zn→a→b→Cu路徑流動
C. 鹽橋中K+向移向ZnSO4溶液
D. 片刻后可觀察到濾紙b點變紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是典型晶體的結構示意圖,從①到⑥對應正確的是:
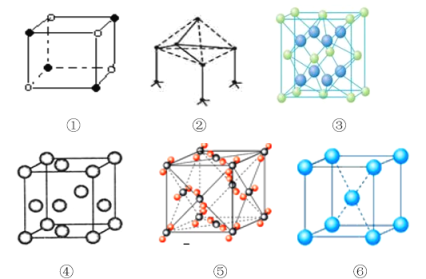
選項 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 單質硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金剛石 | Cu | CO2 | CsCl |
C | CsCl | 金剛石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)H2O的摩爾質量為:_____________,36 g 水的物質的量為:________________。如果將這36g水完全電解生成H2和O2,則所得H2在標況下的體積約為:__________。
(2)6.02×1024個H2O分子所含的氫原子數與___________ mol H2O2所含的氫原子數相等。
(3)1 mol Na2O2中所含陰離子數的個數約為:_________NA。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KIO3是一種重要的無機化合物,可作為食鹽中的補碘劑,常見制備方法如下。
(1)氯酸鉀氧化法:化學反應方程式為:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反應中轉移的電子數為______,向反應后溶液中加______溶液得到KIO3。
(2)一種由含碘廢水制取碘酸鉀的工藝如圖:

①進行“過濾1”時,需同時對CuI沉淀進行洗滌。在洗滌液中可通過滴加______鹽溶液來檢驗其是否已洗滌干凈。
②“制FeI2”時,發生反應的化學方程式為______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化劑)和淀粉,不停地攪拌,反應機理為:第一步IO3-+5I-+6H+=3I2+3H2O第二步反應的離子方程式為______。
當反應進行到1.5min時,溶液突然變為藍色,隨之又很快消失,則第______步反應速率快。
④改變反應溫度,重復上述實驗,得到溫度(T)與溶液變藍所需時間(t)的關系如圖所示(超過50℃后溶液不會再變藍)。根據圖象,請你分析溫度低于50℃時,溶液變藍所需時間與反應溫度的關系:_________。

(3)山東省已下調食用鹽碘含量標準每千克鹽含碘25毫克(波動范圍為18~33mgkg-1)。測定食鹽試樣中碘元素含量的步驟如下:稱取4.000g市售食鹽加入錐形瓶中,依次加入適量的水、稍過量KI及稀硫酸;充分反應后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,與生成的碘恰好完全反應。有關反應原理為:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。計算該食鹽試樣中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應在任何溫度下均能自發進行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1).對于下列反應:2SO2 + O2 ![]() 2SO3 , 如果2min內SO2的濃度由6 mol/L下降為2 mol/L,那么,用SO2濃度變化來表示的化學反應速率為__________,用O2濃度變化來表示的反應速率為__________。
2SO3 , 如果2min內SO2的濃度由6 mol/L下降為2 mol/L,那么,用SO2濃度變化來表示的化學反應速率為__________,用O2濃度變化來表示的反應速率為__________。
(2)反應N2+3H2![]() 2NH3 ΔH<0 ,達平衡后,不同時刻改變外界條件時正逆反應速率變化如圖,請判斷某時刻所改變的條件。
2NH3 ΔH<0 ,達平衡后,不同時刻改變外界條件時正逆反應速率變化如圖,請判斷某時刻所改變的條件。

可能改變的外界條件:t1__________,t2__________ ,t3__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y是合成香料、醫藥、農藥及染料的重要中間體,可由X在酸性條件下反應得到:

下列說法正確的是( )
A. X分子中所有碳原子可能共平面
B. X、Y分別與足量H2加成后的分子中均含有手性碳原子
C. Y可以發生顯色、氧化和還原反應,還可以與甲醛發生縮聚反應
D. 等物質的量的X、Y分別與NaOH溶液反應,最多消耗NaOH的物質的量之比為4∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷和鎳均為重要的無機材料,在化工領域具有廣泛的應用。
(1)基態As原子的價層電子的電子云輪廓圖形狀為_____________。與砷同周期的主族元素的基態原子中,第一電離能最大的為_____________(填元素符號。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反應呈黃色,金屬元素能產生焰色反應的微觀原因為__________________________。
②Na3AsO3中所含陰離子的立體構型為_____________,寫出一種與其互為等電子體的分子:_____________(填化學式)。
(3) 可用于合成Ni2+的配體,M中C原子的雜化方式為___________,其所含
可用于合成Ni2+的配體,M中C原子的雜化方式為___________,其所含![]() 鍵和π鍵的數目之比為___________。
鍵和π鍵的數目之比為___________。
(4)Ni與Ca處于同一周期,且核外最外層電子構型相同,但金屬Ni的熔點和沸點均比金屬Ca的高,其原因為___________。區分晶體Ni和非晶體Ni的最可靠的科學方法為___________。
(5)某砷鎳合金的晶胞結構如下圖所示,設阿伏加德羅常數的值為NA,則該晶體的密度ρ=___________g·cm-3。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com