
【題目】(1)二氧化碳的摩爾質量是 _________,9g水的物質的量是_____,0.5mol CH4在標準狀況下的體積約為_______________。
(2)等質量的CO和CO2在同溫同壓下的體積之比為_________,所含O原子個數之比為_________。
(3)3.1 g Na2X含有Na+ 0.1 mol,則Na2X的摩爾質量為________,X的相對原子質量為________。。
(4)14 g C2H4與C4H8的混合物所含質子的物質的量為________。
【答案】44 g/mol0.5 mol11.2 L11∶711∶1462 g/mol168 mol
【解析】
(1)二氧化碳的相對分子質量為44,則二氧化碳摩爾質量為44 gmol-1;水的摩爾質量為18g/mol,9g水的物質的量是![]() =0.5mol;0.5mol CH4在標準狀況下的體積約為0.5mol×22.4L/mol=11.2L;
=0.5mol;0.5mol CH4在標準狀況下的體積約為0.5mol×22.4L/mol=11.2L;
(2)假設質量都為1g,則CO的物質的量為![]() mol、CO2的物質的量為
mol、CO2的物質的量為![]() mol,同溫同壓下,氣體體積之比等于其物質的量之比,CO和CO2的體積之比=
mol,同溫同壓下,氣體體積之比等于其物質的量之比,CO和CO2的體積之比=![]() mol:
mol:![]() mol=11:7;二者含O原子個數之比為
mol=11:7;二者含O原子個數之比為![]() mol×1:
mol×1:![]() mol×2=11:14;
mol×2=11:14;
(3)Na2X中含有的Na+物質的量為0.1mol,則Na2X的物質的量為0.05mol,M(Na2X)=![]() =62g/mol;X的相對原子質量為62-2×23=16;
=62g/mol;X的相對原子質量為62-2×23=16;
(4)C2H4與C4H8的最簡式都為CH2,則14g C2H4與C4H8的混合物中含有最簡式CH2的物質的量為:n(CH2)=![]() =1mol,1個CH2含有8個質子,則1mol CH2中含有質子的物質的量為:1mol×8=8mol。
=1mol,1個CH2含有8個質子,則1mol CH2中含有質子的物質的量為:1mol×8=8mol。


 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,向一定體積0.1 mol/L氨水中逐滴加入等濃度的鹽酸,溶液中pH與pOH的變化關系如右圖所示。下列說法錯誤的是( )
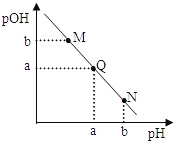
A. 此溫度下,水的離子積常數為1.0×10 -2a
B. N點溶液加水稀釋,![]() 增大
增大
C. M、Q、N三點所示的溶液中,c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D. Q點消耗的鹽酸的體積等于氨水的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅酸鹽在地殼中分布很廣,可用蛭石生產硫酸鎂和氫氧化鎂。某地蛭石的主要成分是[(Mg2.36Fe0.48Al0.16)(Si2.72Al1.28)O10(OH)2] ·[Mg0.32(H2O)0.42],還含有少量雜質FeO。
實驗步驟如下:
Ⅰ.制取粗硫酸鎂:用硫酸浸泡蛭石礦粉,過濾,將濾液結晶得到粗硫酸鎂。
Ⅱ.提純粗硫酸鎂:將粗硫酸鎂在酸性條件下溶解,加入適量的0.1mol·L—1H2O2溶液,再加試劑A調節溶液pH,并分離提純。
Ⅲ.制取氫氧化鎂:向步驟Ⅱ得的溶液中加入過量氨水。
一些金屬離子轉化為氫氧化物沉淀時溶液的pH如表1所示
表1
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
開始沉淀時 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀時 | 3.7 | 5.2 | 9.7 |
請回答:
(1)在步驟Ⅱ中加H2O2溶液的目的是___________。調節溶液pH的范圍是______________。試劑A的最佳選擇是_________(填字母序號)。
A、MgO B、Na2CO3 C、蒸餾水 D、稀硫酸
(2)測定粗硫酸鎂中Fe2+的含量。稱取12.3g粗硫酸鎂樣品溶于水形成溶液,完全轉移到錐形瓶中,加稀硫酸酸化,滴加幾滴黃色鐵氰化鉀K3[Fe(CN)6]溶液,用0.010 mol·L—1H2O2溶液進行滴定。平行測定4組,消耗H2O2溶液的體積數據記錄如表2所示。
表2
實驗編號 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的體積/mL | 12.49 | 12.50 | 13.62 | 12.51 |
①K3[Fe(CN)6]與Fe2+反應生成帶有特征藍色的鐵氰化亞鐵沉淀,請寫出反應的離子方程:________。
②反應達到終點時的標志是_________________________________________________。
③根據表2數據,可計算出粗硫酸鎂樣品中含有Fe2+_______________mol。
(3)工業上常以Mg2+的轉化率為考查指標來確定步驟Ⅲ制備氫氧化鎂工藝過程的適宜條件。
①步驟Ⅲ中制備氫氧化鎂反應的離子方程式為_________________________。
②已知25℃時,Mg(OH)2和Ca(OH)2的Ksp分別為2×10-11和4.7×10—6。若用石灰乳替代氨水,__________(填“能”或“不能”)制氫氧化鎂,理由是_____________________________。
③通常認為殘留在溶液中的離子濃度小于1×10-5 mol·L-1時就認為沉淀完全,Mg2+完全沉淀時溶液的pH為________。(保留小數點后一位)(已知lg2=0.3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為![]() 的四種溶液pH如下表依據已有的知識和信息判斷,下列說法正確的是
的四種溶液pH如下表依據已有的知識和信息判斷,下列說法正確的是![]()
溶質 |
| NaClO |
|
|
pH |
|
|
|
|
A. 常溫下, ![]() 的水解能力強于其電離能力
的水解能力強于其電離能力
B. 常溫下,相同物質的量濃度的![]() 、
、![]() 、
、![]() 依次升高
依次升高
C. ![]() 溶液中存在以下關系:
溶液中存在以下關系: ![]()
D. 向氯水中加入少量![]() 固體,不能增大HClO的濃度
固體,不能增大HClO的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,將a L HCl完全溶于水得到V mL鹽酸,溶液的密度為ρ g·cm-3,溶質的質量分數為w,溶質的物質的量濃度為c mol·L-1。下列敘述中正確的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的質量分數大于0.5w ④將50 g上述溶液加入一定量的水稀釋成0.5c mol·L-1,則加入水的體積應大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的質量分數大于0.5w ④將50 g上述溶液加入一定量的水稀釋成0.5c mol·L-1,則加入水的體積應大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列說法不正確的是
A. 9 g![]() 中含有的電子數為3.6 NA
中含有的電子數為3.6 NA
B. 某溫度下純水的pH=6,該溫度下1L pH=11的NaOH溶液中含OH-的數目為0.1NA
C. 一定溫度下,1 L 0.5 mol·L-1 NH4Cl溶液與2 L 0.25 mol·L-1NH4Cl溶液含![]() 均為0.5NA
均為0.5NA
D. 丙烯和環丙烷組成的42 g混合氣體中氫原子的個數為6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖甲、乙、丙為組成生物體的相關化合物,乙為一個由α、β、γ三條多肽鏈形成的蛋白質分子,共含271個氨基酸,圖中每條虛線表示由兩個硫基(-SH)脫氫形成一個二硫鍵(-S-S-)。下列相關敘述不正確的是
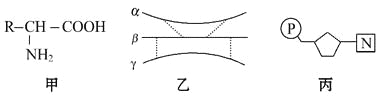
A. 甲為組成乙的基本單位,且乙中最多含有20種甲
B. 由不同的甲形成乙后,相對分子質量比原來少了4 832
C. 丙主要存在于細胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R為C3H5O2,則由兩分子甲形成的化合物中含有16個H
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com