
【題目】(1)下列物質:①氯氣、②銅片、③碳酸鈣、④蔗糖、⑤HCl氣體、⑥SO2氣體、⑦氨水,能導電的是________________,屬于電解質的是_________________。(填編號)
(2)節日焰火利用的是_________反應,城市射燈在夜空形成五顏六色的光柱,屬于______效應。
(3)在 2Na2O2+2CO2===2Na2CO3+O2反應中,_________是還原劑,_________是氧化劑。若轉移3mol電子,則所產生的O2在標準狀況下的體積為_________。
(4)①除去鐵粉中混用鋁粉,選用的試劑為:___________;
②NaHCO3溶液中混有Na2CO3 選用的試劑為________________________;
③除去Na2CO3粉末中的NaHCO3 ,采用的方法___________。
【答案】 ②⑦ ③⑤ 焰色 丁達爾 Na2O2 Na2O2 33.6L NaOH溶液 通入CO2 加熱
【解析】(1)①氯氣是單質,既不是電解質,也不是非電解質,氯氣不能導電;②銅是金屬單質,既不是電解質,也不是非電解質,銅能導電;③碳酸鈣是鹽,在水溶液中雖難溶,但熔化狀態下都能完全電離出自由移動的離子而導電,是電解質;碳酸鈣固體沒有自由移動的離子,不能導電;④蔗糖是以分子的形式分散在水中形成的溶液不能導電,不屬于電解質,屬非電解質;蔗糖固體以分子的形式存在不導電;⑤HCl氣體不能導電,溶于水能導電,屬于電解質;⑥SO2不能導電,溶于水能導電是因為生成了亞硫酸,亞硫酸導電,SO2是非電解質;⑦氨水是氨氣溶于水形成的混合物,既不是電解質,也不是非電解質,但是溶液中存在自由移動的離子,能導電;故答案為:②⑦;③⑤;(2)節日焰火利用的是焰色反應,城市射燈在夜空形成五顏六色的光柱,屬于丁達爾效應;(3)在 2Na2O2+2CO2=2Na2CO3+O2反應中,過氧化鈉中氧元素從-1價變為了2價和0價,化合價有升有降,既是還原劑,又是氧化劑。根據反應2Na2O2+2CO2=2Na2CO3+O2,若有1mol Na2O2參與反應,轉移電子數為1mol,生成0.5mol氧氣,則若轉移3mol電子時,所產生的O2在標準狀況下的體積為3×0.5mol×22.4L/mol=33.6L;(3)①鋁粉與強堿溶液反應生成溶于水的偏鋁酸鈉,反應的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可加入NaOH溶液除去鐵粉中的鋁粉;②Na2CO3可與CO2反應生成NaHCO3而除去,反應的離子方程式為CO32-+CO2+H2O=2HCO3-,所以可以通入CO2除去NaHCO3溶液中混有Na2CO3;③除去Na2CO3粉末中的NaHCO3 ,采用的方法充分加熱,碳酸氫鈉受熱分解,2NaHCO3![]() Na2CO3+H2O+CO2↑,Na2CO3受熱不分解。
Na2CO3+H2O+CO2↑,Na2CO3受熱不分解。


科目:高中化學 來源: 題型:
【題目】33.6g 含雜質的Na2CO3、NaHCO3均勻混合物平均分成兩份,向一份中加入250ml 1.00mol·L-1過量鹽酸反應,生成標準狀況下3.36L氣體。將另一份充分灼燒,干燥后稱得固體質量為13.7g。雜質不與酸反應,受熱也不分解。求:
(1)原混合物中含有Na2CO3的物質的量。
(2)Na2CO3、NaHCO3的質量比。(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】強酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干種,某同學為了確認其成分,取X溶液進行連續實驗,實驗過程及產物如下:

下列結論正確的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B. 氣體F經催化氧化可直接生成氣體D
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D. X中不能確定的離子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設反應:A(s)=B(g) +C(g) △H—T△S=(—4500+11T ) J·mol-1,要防止反應發生,溫度必須 ( )
A.低于136K
B.高于409K
C.高于136K而低于409K
D.低于409K
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美國科學家合成了含有N5+的鹽類,含有該離子的鹽是高能爆炸物質,該離子的結構呈V形,如圖所示(圖中箭頭代表單鍵)。下列有關該物質的說法中正確的是

A. 每個N5+中含有35個質子和36個電子 B. 該離子中只含有非極性鍵
C. 該離子中含有2個π鍵 D. N5+與PO43-互為等電子體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是 ( )
A. 含多個電子的原子里,能量高的電子在離核近的區域運動
B. 每個電子層最多容納的電子數是2n2個
C. 最外層電子數不超過8個(K層為最外層時,電子數不超過2個)
D. 核外電子是分層排布的,元素的化學性質與原子的最外層電子排布密切相關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:硫酸銅溶液中滴入氨基乙酸鈉(H2N-CH2-COONa)即可得到配合物A。其結構如圖4所示:
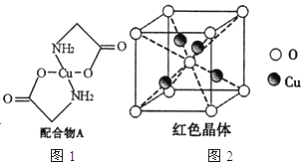
(1)Cu元素基態原子的外圍電子排布式為______________。
(2)元素C、N、O的第一電離能由大到小排列順序為_______________。
(3)配合物A中碳原子的軌道雜化類型為_______________________。
(4)1mol氨基乙酸鈉(H2N-CH2-COONa)含有![]() 鍵的數目為____________mol。
鍵的數目為____________mol。
(5)氨基乙酸鈉分解產物之一為二氧化碳。寫出二氧化碳的一種等電子體:____________(寫化學式)。
(6)已知:硫酸銅灼燒可以生成一種紅色晶體,其結構如圖2所示,則該化合物的化學式是_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com