
【題目】一種形狀像布袋結構的烯烴分子,其形狀和結構如圖所示,有關說法不正確的是( )

A. 該烯烴的分子式為C5H4
B. 該分子所有碳原子在同一平面
C. 1 mol該有機物最多可與2 mol Br2發生加成反應
D. 與其互為同分異構體且只含三鍵的鏈烴不止—種
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 常溫下同濃度的強酸、強堿等體積混合后由水電離出的c(H+)一定為10-7mol·L-l
B. 常溫下pH =2的鹽酸和pH =12的氨水等體積混合后生成NH4Cl,溶液顯酸性
C. 常溫下0.1 mol·L-1的Na2A溶液的pH=10,則該溶液中由水電離的c(OH-)= 10-10 mol·L-l
D. 常溫下向CH3COONa稀溶液中加入CH3COONa固體,c (CH3COO-)/c(Na+)比值變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知HA的酸性弱于HB的酸性。25℃時,用NaOH固體分別改變物質的量濃度均為0.1 molL-1的HA溶液和HB溶液的pH(溶液的體積變化忽略不計),溶液中A-、B-的 物質的量濃度的負對數與溶液的pH的變化悄況如圖所示。

下列說法正確的是( )
A. 曲線Ⅰ表示溶液的pH與-lgc(A-)的變化關系
B. ![]()
C. 溶液中水的電離程度:M>N
D. N點對應的溶液中c(Na+)>Q點對應的溶液中c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在濃度均為4.0 mol·L-1的鹽酸和硫酸各100 mL溶液中,分別加入等質量的鋅粉,充分反應后生成氣體體積比為2∶3,則加入鋅粉的質量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣含氮氧化物(NOX)、碳氫化合物(CXHY)、碳等,直接排放容易造成“霧霾”。因此,不少汽車都安裝尾氣凈化裝置(凈化處理過程如圖)。下列有關敘述,錯誤的是
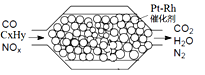
A. 尾氣造成“霧霾”與汽油未充分燃燒有關
B. 尾氣處理過程,氮氧化物(NOX)被還原
C. Pt-Rh催化劑可提高尾氣凈化反應的平衡轉化率
D. 使用氫氧燃料電池作汽車動力能有效控制霧霾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤煙氣脫除SO2及NOx對解決霧霾污染很重要,脫硫脫硝的方法很多,一種ClO2氣相氧化法反應機理和速率常數(K)如下:
脫硝:①NO(g)+ ClO2(g)= NO2(g)+ ClO(g) △H1 k1=l.7×1011mL·(mol·s)-1
②NO(g)+ ClO(g)= NO2(g)+Cl(g) △H2 k2=8.8×1012 mL·(mol·s)-1
脫硫:③SO2(g)+ClO2(g)=SO3(g)+ClO(g) △H3 k3=2.1×10-4 mL·(mol·s)-1
④SO2(g)+ClO(g)=SO3(g)+ Cl(g) △H 4 k4=6.9×1011 mL·(mol·s)-1
兩過程中產生的Cl可與ClO2進一步反應,如:
⑤C1(g)+ClO2(g)=2ClO(g) △H5
(1)同時脫硫脫硝反應NO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)的反應熱最簡表達式△H=____________。
(2)己知反應③④的速率方程分別為v正=k3·c (SO2) · c (ClO2)、v正=k4·c (SO2) · c (ClO),試判斷兩反應的活化能大小,E3____________E4(填“>”“<”或“=”)。控制脫硫速度的關鍵步驟是____________反應(填③或④)
(3)SO2、NO單獨氧化及同時氧化對兩氣體氧化率變化如圖,同時氧化對____________氣體的氧化率影響明顯,結合①③④反應及其速率常數分析原因____________。

(4)氣相中水蒸氣含量提高,SO2單獨氧化率會迅速提升,并生成兩種常見的酸,請寫出該過程化學反應方程式__________________________________。
(5)“濕式吸收法”利用吸收劑與SO2發生反應從而達脫硫目的。
①下列適合作該法吸收劑的是____________(填序號)。
A.氨水 B. Na2SO4溶液 C. Na2CO3 溶液D. NaHSO4溶液
②用石灰水也可吸收SO2,生成亞硫酸鈣濁液。
計算 CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)的平衡常數K=____________。25℃時,H2SO3電離常數為:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
Ca2+(aq)+HSO3-(aq)的平衡常數K=____________。25℃時,H2SO3電離常數為:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密閉容器中充入0.1molCH4和0.2molH2S,不斷升高溫度,測得平衡時體系中各物質的物質的量分數與溫度的關系如圖所示:
CS2(g)+4H2(g)。向恒容密閉容器中充入0.1molCH4和0.2molH2S,不斷升高溫度,測得平衡時體系中各物質的物質的量分數與溫度的關系如圖所示:

下列說法正確的是
A. 該反應的△H<0
B. 維持Z點溫度,向容器中再充入CH4、H2S、CS2、H2各0.1mol時,v(正)>v(逆)
C. X點與Y點容器內壓強比為51:55
D. X點CH4的轉化率為20%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正四面體烷是一種可能存在的柏較圖輕,IUPAC名稱為三環[1. 1. 0. 0]丁烷。其球棍模型如圖所示。下列關于該化合物的說法正確的是

A. 與環丁二烯互為同分異構體
B. 二氯代物超過兩種
C. 碳碳鍵鍵角為109°28'
D. 三環[1.1. 0.0] 丁烷生成1 mol 丁烷至少需要2mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知N2O4(g)![]() 2NO2(g) ΔH=+57.20 kJ/mol,t℃時,將一定量的NO2、N2O4充入一個容積為2 L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
2NO2(g) ΔH=+57.20 kJ/mol,t℃時,將一定量的NO2、N2O4充入一個容積為2 L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
下列推斷不正確的是
A. c(X)代表NO2的濃度
B. 20min時改變的條件是向容器中加入0.8molNO2
C. 該反應的平衡常數K=0.9 mol/L
D. 25min后混合氣體的平均摩爾質量為64.4g·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com