
【題目】硅是無機非金屬材料的主角,硅的氧化物和硅酸鹽約占地殼質量的90%以上。
(1)下列物質不屬于硅酸鹽的是______。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2與氫氧化鈉溶液反應的化學方程式為_____,工藝師常用_____(填物質名稱)來雕刻玻璃。
(3)用Na2SiO3水溶液浸泡過的棉花不易燃燒,說明Na2SiO3可用作______。Na2SiO3可通過SiO2與純堿混合高溫熔融反應制得,高溫熔融純堿時下列坩堝可選用的是_____。
A.普通玻璃坩堝 B.石英玻璃坩堝 C.氧化鋁坩堝 D.鐵坩堝
(4)工業上常利用反應2C+SiO2![]() Si+2CO↑制備硅單質,該反應中所含元素化合價升高的物質是_____(填化學式,下同),氧化劑是_____。
Si+2CO↑制備硅單質,該反應中所含元素化合價升高的物質是_____(填化學式,下同),氧化劑是_____。
【答案】D SiO2+2NaOH=Na2SiO3+H2O 氫氟酸 防火劑 D C SiO2
【解析】
(1)根據常見的硅酸鹽材料結合生石灰是氧化鈣的俗名分析判斷;
(2)二氧化硅與氫氧化鈉反應生成硅酸鈉和水;氫氟酸能夠與二氧化硅反應生成四氟化硅和水;
(3)水玻璃是礦物膠,不燃燒;二氧化硅、氧化鋁能夠與堿反應;
(4)依據化學方程式判斷元素化合價變化,化合價降低的反應物為氧化劑。
(1)陶瓷、玻璃、水泥的主要成分都含有硅酸鹽,屬于硅酸鹽產品,生石灰是氧化鈣的俗名,屬于氧化物,不屬于硅酸鹽,故選D;
(2)二氧化硅與氫氧化鈉反應生成硅酸鈉和水,化學方程式:SiO2+2NaOH=Na2SiO3+H2O;氫氟酸能夠與二氧化硅反應生成四氟化硅和水,能夠腐蝕玻璃,可用來雕刻玻璃,故答案為:SiO2+2NaOH=Na2SiO3+H2O;氫氟酸;
(3)水玻璃是礦物膠,不燃燒,可以做阻燃劑,用Na2SiO3水溶液浸泡過的棉花不易燃燒,說明Na2SiO3可用作防火劑;普通玻璃坩堝、石英玻璃坩堝都含有二氧化硅,能夠與堿反應,氧化鋁坩堝的主要成分為氧化鋁,氧化鋁與堿能夠發生反應,Na2SiO3可通過SiO2與純堿混合高溫熔融反應制得,高溫熔融純堿時的坩堝可選用鐵坩堝,故答案為:防火劑;D;
(4)2C+SiO2![]() Si+2CO↑,反應中碳元素化合價升高,二氧化硅中硅元素化合價降低,作氧化劑,故答案為:C;SiO2。
Si+2CO↑,反應中碳元素化合價升高,二氧化硅中硅元素化合價降低,作氧化劑,故答案為:C;SiO2。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】某反應的反應機理、能量與反應進程的關系如圖所示,下列說法正確的是

A. Fe2+是該反應的催化劑B. 第一步反應的能壘比第二步反應的小
C. S2O82-在第一步反應中作還原劑D. 兩步反應都是放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是一種很重要的金屬,可以發生一系列反應制備物質,如圖所示。下列說法錯誤的是
( )

A.反應①又稱鋁熱反應,可用于野外焊接鐵軌
B.反應②③都有氫氣生成,產生等量的氫氣時轉移的電子數相等
C.工業上用反應⑦制備鋁時,常加入冰晶石以降低氧化鋁的熔融溫度
D.常用反應⑥制備Al(OH)3,方法是向Al2(SO4)3溶液中滴加足量的NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)( )

A.反應①②③④⑤均屬于氧化還原反應,反應③還屬于置換反應
B.反應⑤說明該條件下鋁可用于制熔點較高的金屬
C.相同條件下生成等量的O2,反應③和④轉移的電子數之比為1∶1
D.反應①中氧化劑與還原劑的物質的量之比為1∶4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與人類生活密切相關。請按要求,回答下列問題:
(1)K2FeO4是一種重要的凈水劑,可用下列方法制得:2Fe(OH)3 + 3Cl2 +10KOH![]() 2 K2FeO4 + 6KCl +8H2O在該反應中,還原劑是____________,當反應中有1mol K2FeO4生成時,消耗的Cl2在標況下的體積為____________L,轉移電子的數目為____________。
2 K2FeO4 + 6KCl +8H2O在該反應中,還原劑是____________,當反應中有1mol K2FeO4生成時,消耗的Cl2在標況下的體積為____________L,轉移電子的數目為____________。
(2)宇航員常用過氧化鈉作供氧劑,寫出過氧化鈉與二氧化碳反應的化學方程式并用雙線橋法表示電子轉移的方向和數目:_____________________________________________。
(3)廚房里小蘇打常作面包和糕點的發泡劑,寫出小蘇打溶于水的電離方程式:_____。
(4)工業上制漂白粉的化學方程式為________________________________,新制氯水在陽光照射下產生無色氣體,該反應的化學方程式是_________________________。
(5)KAl(SO4)2·12H2O因其溶于水生成_____(化學式)可以吸附雜質,從而達到凈水作用。
(6)硅酸鈉水溶液的俗名為__________,可作為木材_______________的原料。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】緒(Ge)是半導體元素,應用廣泛,回答下列問題:
(1)下列為Ge價電子層電子排布圖表示的狀態中,能量最低和最高的分別為____、_____(填選項)。
A.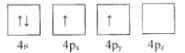 B.
B.
C.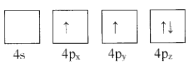 D.
D.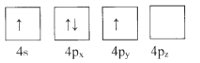
(2)GeH4的空間構型為____;比較與同鍺族的氫化物的沸點如表所示,分析其變化規律及原因____。
CH4 | SiH4 | GeH4 | |
沸點/℃ | -161.5 | -119 | -88.1 |
(3)有機鍺化合物A有一定的醫療保健作用,其結構簡式為CF3N=GeH2,則Ge的雜化形式為____,碳原子與其它原子結合的鍵的種類為_____。
(4)Li2GeF6可以作為鋰電池的電解質,則Li、Ge、F電負性由大到小的順序為_____。
(5)Ge晶胞如下,其中原子坐標參數A為(0,0,0);B為(![]() ,0,
,0,![]() ),D為(
),D為(![]() ,
,![]() ,
,![]() )。則C原子的坐標參數為_____。
)。則C原子的坐標參數為_____。
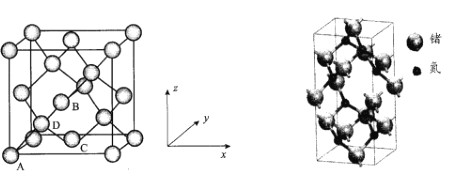
(6)氮化鍺具有耐腐蝕、硬度高等優點,晶體中鍺原子與氮原子之間存在明顯的s-p雜化現象,氮化鍺晶體屬于____晶體。一種氮化鍺晶胞的球棍模型如圖,晶體中n(Ge)/n(N)=____,若晶胞底面正方形的邊長為anm,阿伏加德羅常數值為NA,晶體的密度為ρg/cm3,則長方體的高為____nm(列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由SO2和O2制備SO3(熔點16.8℃,沸點44.8℃)的模擬裝置如下圖所示)(加熱和夾持裝置省略):

下列說法正確的是
A. 裝置①中的試劑為飽和NaHSO3溶液
B. 實驗室可用銅與稀硫酸在加熱條件下制取SO2
C. 裝置③反應管中的鉑石棉用作反應的催化劑
D. 從裝置⑤逸出的氣體有過量的SO2和O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素Q、R、T、W在元素周期表中的位置如圖,其中T原子的M層電子數比K層多2個,下列敘述不正確的是( )
![]()
A. 氫化物的穩定性:R<Q<T
B. T的單質是一種良好的半導體材料
C. Q、R的簡單氫化物分子所含質子數、電子數與氖原子相同
D. T、W的最高價氧化物的水化物的酸性W強于T
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序數依次增大。a、c的基態原子中均有2個未成對電子,c與d位于同一主族,元素e的基態原子的3d軌道上有2個電子,基態f原子M層有2個未成對電子且位于第Ⅷ族。
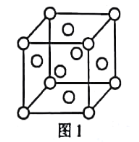
(1)元素e在周期表中的位置為___;f的單質的晶胞結構如圖1所示,該晶胞為___堆積。
(2)c元素可分別與a、b元素組成多種簡單陰離子,其中中心原子采用sp2雜化,空間構型為平面三角形的離子有___(填離子符號)。一個氫原子與一個a原子、一個b原子組成的分子中σ鍵和π鍵的數目之比為___。
(3)基態原子未成對電子數與b相同的前四周期元素中,除了與b同主族的元素外,還有___(填元素符號)。
(4)分子中的大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為![]() ),d元素的低價酸性氧化物其大π鍵應表示___。
),d元素的低價酸性氧化物其大π鍵應表示___。
(5)c、f元素形成的一種晶體的晶胞結構如圖2所示,其單原子層堆積結構實際如圖3所示。
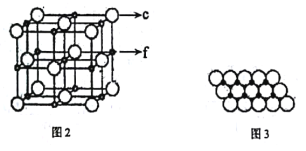
該①晶體的化學式是___。
②如圖3中,c離子之間最短核間距為apm,NA表示阿伏加德羅常數的值。則該晶體中1m2單原子層的質量為___(用含a和NA的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com