
【題目】高鐵酸鉀(K2FeO4)是很好的凈水劑,高鐵酸鋇( BaFeO4)是高能電池陽極的優良材料。已知:K2FeO4為紫色固體,微溶于KOH溶液,在酸性或中性溶液中能快速產生O2,在堿性溶液中較穩定;在堿性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4難溶于水和堿性溶液。某化學興趣小組欲制取“84”消毒液,進而制取少量K2FeO4和 BaFeO4。請回答下列問題:
(實驗一)選擇合適的儀器和試劑制取氯氣,進而制備高濃度的“84”消毒液。

(1)選擇合適的儀器,導管接口正確的連接順序為___________;所選裝置(A或B)中發生反應的離子方程式為______________________。
(實驗二)用“84”消毒液制取K2FcO4
實驗步驟:①用如圖所示裝置(夾持儀器略去)使反應物充分反應;②用砂芯漏斗對燒杯中的溶液進行抽濾,向濾液中慢慢加入KOH溶液;③再用砂芯漏斗對步驟②的最后反應混合物進行抽濾,并用苯、乙醚洗滌沉淀,真空干燥后得K2FeO4。

(2)寫出步驟①中物質在20℃冷水浴中發生反應的化學方程式:______________________。
(3)步驟②中能夠發生反應的原因是______________________,步驟③中不用水,而用苯、乙醚洗滌沉淀的目的是_________________________________。
(實驗三)將上述產品配成K2FeO4堿性溶液,再慢慢加入Ba(OH)2溶液,抽濾得 BaFeO4。
(4)若投入ag硝酸鐵晶體,得到bg高鐵酸鋇,則高鐵酸鋇的產率是___________。[已知Fe(NO3)3·9H2O的摩爾質量為404g·mol-1, BaFeO4的摩爾質量為257g·mol-1]
(實驗四)利用如圖所示電解裝置也可以制得 BaFeO4。

(5)在___________(填“陽極區”或“陰極區”)可得到高鐵酸鋇,陽極的電極反應式為____________。
【答案】a(或b)ihcdg MnO2+2Cl-+4H+![]() Mn2++Cl2↑+H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) 3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O 相同條件下K2FeO4的溶解度小于Na2FeO4的溶解度 避免K2FeO4與水反應,減小K2FeO4的損失,便于K2FeO4的的干燥
Mn2++Cl2↑+H2O(或2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O) 3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O 相同條件下K2FeO4的溶解度小于Na2FeO4的溶解度 避免K2FeO4與水反應,減小K2FeO4的損失,便于K2FeO4的的干燥 ![]() 或
或![]() 陽極區 Fe+8OH-+Ba2+-6e-=BaFeO4+4H2O
陽極區 Fe+8OH-+Ba2+-6e-=BaFeO4+4H2O
【解析】
(1)與NaOH溶液反應制取“84”消毒液的氯氣中不能含有HCl,但含有的水蒸氣不影響反應,所以氯氣的制備裝置應該連接除去氯化氫的飽和食鹽水,再連有冷水浴裝置的氫氧化鈉溶液,最后連接裝置E,防止剩余的氯氣污染空氣,故儀器正確的連接順序是a(或b)ihcdg;
裝置的選擇有兩種情況:選用固液加熱裝置A時就用二氧化錳與濃鹽酸反應MnO2+2Cl-+4H+![]() Mn2++Cl2↑+H2O;選用固液不加熱裝置B時,就用高錳酸鉀與濃鹽酸反應,2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
Mn2++Cl2↑+H2O;選用固液不加熱裝置B時,就用高錳酸鉀與濃鹽酸反應,2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(2)隨著Fe(NO3)39H2O的加入和反應3NaClO+Fe(NO3)3=3NaNO3+Fe(OH)3的進行,另有反應3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O開始進行,兩個反應的總反應為3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(3)根據題干中已知物質的溶解性情況,相同條件下K2FeO4的溶解度小于Na2FeO4,的溶解度,步驟2中的反應為Na2FeO4+2KOH= K2FeO4+ 2NaOH,抽濾后得K2FeO4固體。用水洗滌產物時K2FeO4與水反應,會加大其溶解消耗,用苯或乙醚洗滌,能減少K2FeO4的溶解損失,也便于K2FeO4的干燥;
(4)K2FeO4溶液與Ba(OH)2溶液混合后發生的反應為K2FeO4+Ba(OH)2= BaFeO4+2KOH,從總體反應關系看Fe(NO3)39H2O![]() BaFeO4,ag Fe(NO3)39H2O理論上可以生成BaFeO4
BaFeO4,ag Fe(NO3)39H2O理論上可以生成BaFeO4 ![]() ,BaFeO4的產率為
,BaFeO4的產率為![]() ;
;
(5)Fe作陽極被氧化為FeO42-,FeO42-不能通過陽離子交換膜擴散到陰極區,Ba2+與FeO42-反應生成難溶的BaFeO4,所以在陽極區可獲得高鐵酸鋇,陽極的電極反應式為Fe+8OH-+Ba2+-6e-=BaFeO4+4H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】I “碘鐘”實驗中,3I-+S2O82-===I3—+2SO42-的反應速率可以用![]() 遇加入的淀粉溶液顯藍色的時間t來度量,t越小,反應速率越大。某探究性學習小組在20 ℃進行實驗,得到的數據如下表:
遇加入的淀粉溶液顯藍色的時間t來度量,t越小,反應速率越大。某探究性學習小組在20 ℃進行實驗,得到的數據如下表:
實驗編號 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列問題:
(1)該實驗的目的是____________________________________________________________。
(2)顯色時間t1為________。
(3)通過分析比較上述數據,得到的結論是___________________________________________________。
II根據反應4FeS2+11O2===2Fe2O3+8SO2,試回答下列問題。
(1)通常選用哪些物質來表示該反應的化學反應速率____________。
(2)當生成SO2的速率為0.64 mol·L-1·s-1時,則氧氣減少的速率為________。
(3)如測得4 s后O2的濃度為2.8 mol·L-1,此時間內SO2的速率為0.4 mol·L-1·s-1,則開始時氧氣的濃度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,在容積為2L的密閉容器中,將2 mol 氣體M和3 mol N氣體混合,發生如下反應:2M(g)+3N(g)![]() xQ(g)+3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
xQ(g)+3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
A. x值為2 B. 混合氣體的密度增大
C. N的轉化率為80% D. 混合氣體平均摩爾質量不變,不能說明該反應達平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z為原子序數依次增大的四種短周期元素,其中兩種為非金屬元素。W的氣態氫化物遇到其最高價氧化物對應的水化物產生“白煙”,Z的最外層電子數等于其電子層數的2倍,W和X的最外層電子數之和等于Z的族序數。在含X和Y的可溶性鹽溶液中通入過量的CO2,產生沉淀的質量與CO2體積的關系如圖所示。下列說法正確的是
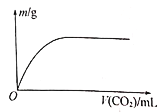
A. 簡單離子半徑:X>Y>Z>W
B. Z的氧化物對應的水化物均為強酸
C. 含Y的陰離子溶液與含Y的陽離子溶液能夠發生反應
D. 工業上可用電解法或熱還原法制備X和Y的單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”,因此研究NOx、SO2等大氣污染物的妥善處理具有重要意義。
(1)SO2的排放主要來自于煤的燃燒,工業上常用氨水吸收法處理尾氣中的SO2。已知吸收過程中相關反應的熱化學方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
則反應2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤發電廠常利用反應2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1對煤進行脫硫處理來減少SO2的排放。對于該反應,在T℃時,借助傳感器測得反應在不同時間點上各物質的濃度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min內,平均反應速率v(O2)___________mol·L-1·min-1;當升高溫度,該反應的平衡常數K___________(填“增大”“減小”或“不變”)。
②30min后,只改變某一條件,反應重新達到平衡。根據上表中的數據判斷,改變的條件可能是___________(填字母)。
A加入一定量的粉狀碳酸鈣 B通入一定量的O2
C適當縮小容器的體積 D加入合適的催化劑
(3) NOx的排放主要來自于汽車尾氣,人利用反應
C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:

由圖可知,1050K前反應中NO的轉化率隨溫度升髙而增大,其原因為____________________;在1100K時,CO2的體積分數為___________。
(4)用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作Kp)。在1050K、1.1×106Pa時,該反應的化學平衡常數Kp=___________[已知:氣體分壓(P分)=氣體總壓(Pa)×體積分數]。
(5)為避免汽車尾氣中的有害氣體對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中CO和NO發生反應2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成無毒的N2和CO2。實驗測得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成無毒的N2和CO2。實驗測得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數___________(填“>”“<”或“=”)k逆增大的倍數。
②若在1L的密閉容器中充入1 molCO和1 molNO,在一定溫度下達到平衡時,CO的轉化率為40%,則![]() =___________。
=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 稀有氣體比較穩定是由于其分子中所有原子最外層都滿足8電子穩定結構
B. 元素周期表有主族、副族、零族等共16縱列
C. 第四周期的Fe、Co、Ni均位于第VIIIB族,所以化學性質相似
D. P3-對應元素位于第三周期第VA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(化學——選修3: 物質結構與性質)
我國考古人員在秦陵挖掘的寶劍,到現在仍然鋒利無比,原因是劍鋒上覆蓋了一層鉻。鉻能形成多種化合物,主要化合價有+2價、+3價、+6價。
請回答下列問題:
(1)基態鉻原子的外圍電子排布式為 ________;與鉻同周期的所有元素中,基態原子最高能層電子數與鉻原子未成對電子數相同的元素是 ________。
(2)鉻原子的各級電離能(I:kJ·mol-1)數據如下表所示,鉻原子逐級電離能增大的原因是 ________。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(3)CrCl3·6H2O實際上是配合物,配位數為6,其固體有三種顏色,其中一種暗綠色固體與足量硝酸銀反應時,1mol 固體可生成1mol氯化銀沉淀。則這種暗綠色固體的化學式為 ________,其中鉻的配體水分子的VSEPR模型為 ________,該配合物中存在的作用力有 ________ (填標號)。
A.離子鍵 B.配位鍵 C.共價鍵 D.金屬鍵
(4)CrO3能將乙醇氧化為乙醛,二者的相對分子質量相近,但乙醇的沸點比乙醛高,原因是 ________。
(5)某鑭(La)鉻(Cr)型復合氧化物具有巨磁電阻效應,晶胞結構如圖所示:

①該晶體的化學式為 ________。
②該晶體中距離鑭原子最近的鉻原子有 ________個;若兩個距離最近的氧原子核間距為a pm,組成物質的摩爾質量為b g·mol-1,阿伏加德羅常數值為NA,則晶體密度的表達式為 ______ g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物W用作調香劑、高分子材料合成的中間體等,制備W的一種合成路線如下。

請回答下列問題:
(1)F的化學名稱是_______________,①的反應類型是_______________。
(2)B中含有的官能團是_______________(寫名稱),
(3)D聚合生成高分子化合物的化學方程式為________________。
(4)反應③的化學方程式是___________________。
(5)芳香化合物N是A的同分異構體,其中核磁共振氫譜為三組峰的結構簡式為_________________。
(6)分子式C9H10O2的有機物,其結構中含有苯環且可以與飽和NaHCO3溶液反應放出氣體的同分異構體有__________________種(不考慮立體異構)。
(7)參照有機物W的上述合成路線,設計以M為起始原料制備F的合成路線(無機試劑任選)。____________
![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com