
【題目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在該溶液中可以大量共存的離子組是 ( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3- D. H+、K+、Cl-、Na+
 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,反應H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常數K=
H2O(g)+CO(g)的平衡常數K=![]() 。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2(g)和CO2(g),其起始濃度如表所示:
。該溫度下,在甲、乙、丙三個恒容密閉容器中,投入H2(g)和CO2(g),其起始濃度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判斷不正確的是( )
A. 反應開始時,丙容器中化學反應速率最大,甲容器中化學反應速率最小
B. 平衡時,乙容器中CO2的轉化率大于60%
C. 平衡時,甲容器中和丙容器中H2的轉化率均是60%
D. 平衡時,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢鋇渣(主要成分為BaS2O3,含少量SiO2)為原料生產高純氟化鋇的流程如下:
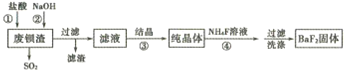
已知:Kap(BaS2O3)=6.96×10-11,Kap(BaF2)=1.0×10-6
(1)步驟①除產生SO2外,還有淡黃色固體生成,該反應的離子方程式為______________。
(2)步驟②的目的是中和過量的鹽酸,加入NaOH溶液不宜過量,其原因是__________(用離子方程式表示)。
(3)濾液的主要成分是BaCl2,還含有少量NaCl,溶解度數據如下表:
溫度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 36.0g | 36.6g | 37.3g | 39.0g | 39.8g |
BaCl2 | 35.8g | 40.8g | 46.2g | 52.5g | 59.4g |
步驟③宜采用_____ (填“蒸發結晶”或“降溫結晶”)。
(4)工業上可用氨水吸收SO2,并通入空氣使其轉化為銨態氮肥。該轉化中氧化劑與還原劑的物質的量之比為__________。
(5)步驟④生成BaF2的反應類型為____________。
①若該反應溫度過高,容易造成c(F-)降低的原因是__________。
②研究表明,適當增加NH4F的比例有利于提高BaF2的產率和純度,將濃度為0. 1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等體積混合,所得溶液中c(Ba2+)=__________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】收藏的清末鋁制藝術品至今保存完好,該藝術品未被銹蝕的主要原因是( )
A.鋁不易被氧化
B.鋁的氧化物在空氣中易變成鋁
C.鋁的密度小,是一種輕金屬
D.鋁易被氧化,形成的氧化膜有保護作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用氯酸鉀和二氧化錳制取氧氣的反應方程式為2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列問題:
(1)該反應中被氧化的元素的名稱為____,生成1 mol O2時轉移電子的數目是________。
(2)從反應后的固體混合物中分離出難溶于水的MnO2的具體實驗操作名稱:________。
(3)分離出的MnO2可用于實驗室制取Cl2,化學方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,其離子方程式為________________________________。
MnCl2+Cl2↑+2H2O,其離子方程式為________________________________。
(4)若兩個反應中轉移的電子的物質的量相同,則生成的O2和Cl2在相同狀況下的體積比為________。
(5)用雙線橋法標明MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O電子轉移的方向和數目_______。
MnCl2+Cl2↑+2H2O電子轉移的方向和數目_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列原子或離子的電子排布式或排布圖正確的是________(填序號,下同),違反能量最低原理的是____________,違反洪特規則的是________,違反泡利原理的是________。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:![]() ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6⑦C:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(3分)下列與化學概念有關的說法正確的是( )
A. 化合反應均為氧化還原反應
B. 金屬氧化物均為堿性氧化物
C. 催化劑能改變可逆反應達到平衡的時間
D. 石油是混合物,其分餾產品汽油為純凈物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中的曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素的有關性質):
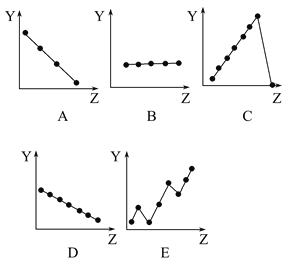
把與元素有關性質相符的曲線的標號填入相應括號中:
(1)ⅡA族元素原子的價電子數___________;
(2)第三周期元素的最高正化合價___________;
(3)F-、Na+、Mg2+、Al3+四種離子的離子半徑___________;
(4)第二周期元素的原子半徑(不包括稀有氣體) ___________;
(5)第二周期元素的第一電離能 ___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是有色金屬,被廣泛地應用于電氣、輕工、機械制造、建筑工業、國防工業等領域,銅的冶煉和加工對于現代社會有著重要的意義。
(1)工業上可用黃銅礦冶煉粗銅,簡要流程如下:
![]()
在轉爐中,經過兩步反應生成粗銅,其的熱化學方程式分別為:
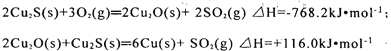
則總反應的熱化學方程式為:_______________________________________;
(2)粗銅可用電解法精煉,電解過程中,粗銅應做____極;精銅一側電極反應式為__________;
(3)電解精煉時粗銅中Fe、Zn等雜質元素會進入電解質溶液,一段時間后需要對電解液除雜凈化,其中除去鐵元素的一種操作如下:
![]()
下表為部分陽離子以氫氧化物形式沉淀時溶液的pH:

①試劑a是_______________,其作用是_________________________________________;
②溶液A加入CuO調節pH的目的是________________________________________(用必要的離子方程式和適當的文字說明)。
③操作①名稱是________________。
(4)電解槽陽極泥中含有Ag、Au等貴金屬,分離提純Au的工藝流程如下:
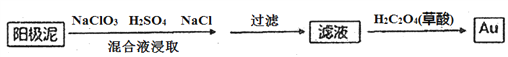
①濾液中Au元素的存在形式為[AuC14]-,寫出浸取步驟反應的離子方程式________________。
②加入草酸后,濾液中發生氧化還原反應,生成Au單質,該反應中氧化劑和還原劑的物質的量之比為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com