
【題目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲線如圖所示,有關粒子的濃度關系正確的是
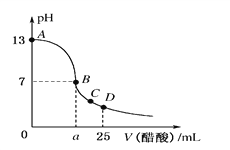
A. 在A、B間任一點,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-)
B. 在B點,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. 在C點:c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
D. 在D點:c(CH3COO-)+c(CH3COOH)=2c(Na+)
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】20℃時,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分數δ隨溶液pH變化的關系如圖所示。下列說法正確確是
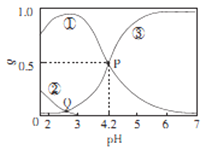
A. ①表示H2C2O4的分布曲線,③表示C2O42-的分布曲線
B. 20℃時,H2C2O4的二級電離平衡常數Ka=1×10-4.2
C. Q點對應溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20世紀末,科學家發現海底存在大量天然氣水合物晶體。在天然氣水合物晶體中,有甲烷、氧氣、二氧化碳、硫化氫、稀有氣體等,它們在水合物晶體里是裝在幾個水分子構成的籠內,因而又稱為籠狀化合物。
(1)區分晶體和非晶體最可靠的科學方法是___________。
(2)基態C原子中,核外電子占據的最高能層的符號是______,該能層最高能級電子的電子云輪廓形狀為________。
(3)H2S分子中中心原子的雜化方式為_______。H2S中H-S-H的鍵角比CH4中H-C-H的鍵角_______(填“大”“小”或“相等”)。
(4)CH4、CO2與H2O形成的籠狀結構如圖所示,其相關參數見下表。CH4與H2O形成的水合物晶體俗稱“可燃冰”。
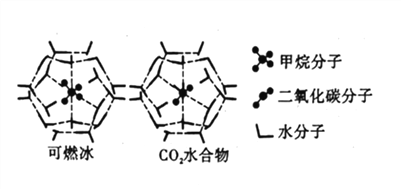
物質 | 分子直徑(nm) | 分子與H2O的結合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②為開采深海海底的“可燃冰”,有科學家提出用CO2置換CH4的設想。已知上圖中籠狀結構的空腔直徑為0.586nm,根據上述圖表分析,該設想的依據是_____________。
(5)已知稀有氣體化合物XeF2的空間構型如圖所示,據此判斷中心原子Xe的雜化方式為_______(填序號)。
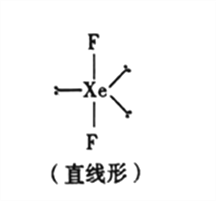
A.sp雜化 B.sp2雜化 C.sp3雜化 D.sp3d雜化
(6)氧氣的晶體結構與CO2相似,晶體中若以一個分子為中心,其周圍有_____個緊鄰的分子,若緊鄰的兩個分子之間距離為anm,列式表示氧氣晶體的密度為______g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活、生產和社會發展密切相關。下列說法正確的是
A. 《天工開物》中“凡石灰,經火焚煉而用”里的石灰,指的是Ca(OH)2
B. 某品牌的八寶粥不含任何糖類物質,糖尿病人可以放心食用
C. 未成熟的蘋果肉遇碘酒變藍,成熟蘋果的汁液不能與銀氨溶液反應
D. 用氯化鐵溶液洗滌銀鏡反應后的試管比用硫酸鐵溶液效果好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數,下列說法正確的是
A. 9gD2O中含有的電子數為5NA
B. 氫氧化鐵膠體帶正電荷。用含0.1mol的FeCl3溶液制成的氫氧化鐵膠體中,膠粒數小于0.1NA
C. 常溫下,7.8gNa2O2與100mL0.05mol/L的HCl溶液反應,產生的氣體體積大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物質的量之和為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的裝置中,若通入直流電5 min時,銅電極質量增加2.16 g。
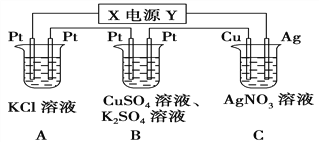
(1)電源電極X的名稱為________;
(2)A中發生的離子方程式為_______________________
(3)B中陽極的電極反應式為___________________________
(4)pH變化:A_______,B_______,C_______。(填“增大”“減小”或“不變”)
(5)通電5 min后,B中共收集224 mL氣體(標準狀況),溶液體積為200 mL,則通電前CuSO4溶液的物質的量濃度為______________(設電解前后溶液體積無變化)。
(6)若A中KCl溶液的體積也是200 mL,電解后,溶液的pH為_______(設電解前后溶液體積無變化)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NO2、NO、CO、NO2-等是常見大氣污染物和水污染物,研究NO2、NO、CO、NO2-等的處理對建設美麗中國具有重要意義。
已知:①NO2+CO![]() CO2+NO,該反應的平衡常數為K1(下同)。斷開1mol下列物質的所有化學鍵時所消耗能量分別為:
CO2+NO,該反應的平衡常數為K1(下同)。斷開1mol下列物質的所有化學鍵時所消耗能量分別為:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
寫出NO與CO反應生成無污染氣體的熱化學方程式:_____________,此熱化學方程式的平衡常數K=_______(用K1、K2、K3表示)
(2)污染性氣體NO2與CO在一定條件下的反應為2NO2+4CO![]() 4CO2+N2,某溫度下,在1L密閉容器中充入0.1molNO2和0.2molCO,此時容器的壓強為1個大氣壓,5秒時反應達到平衡,容器的壓強變為原來的
4CO2+N2,某溫度下,在1L密閉容器中充入0.1molNO2和0.2molCO,此時容器的壓強為1個大氣壓,5秒時反應達到平衡,容器的壓強變為原來的![]() ,則反應開始到平衡時CO的平均反應速率v(CO)=_______。若此溫度下,某時刻則得NO2、CO、CO2、N2的濃度分別為amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反應向逆反應方向進行,a的取值范圍為________。
,則反應開始到平衡時CO的平均反應速率v(CO)=_______。若此溫度下,某時刻則得NO2、CO、CO2、N2的濃度分別為amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反應向逆反應方向進行,a的取值范圍為________。
(3)研究發現:NOx是霧霾的主要成分之一,NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同條件下,在2L恒容密閉容器中,選用不同的催化劑,上述反應產生N2的物質的量隨時間變化的情況如圖所示。
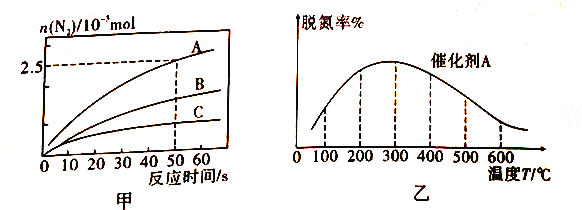
a.在催化劑A作用下,反應達到平衡的標志是_____(填序號)。
A.4v(NH3)正=6v(H2O)逆
B.容器內總壓強不再改變
C.容器內密度不再改變
D.NO 和H2O(g)濃度相等
E.容器內平均摩爾質量不再改變
b.在A、B,C 三種催化劑下,清除氮氧化物反應的活化能分別表示為Ea(A)、Ea(B)、Ea(C),根據圖甲所示曲線,判斷三種催化劑條件下,活化能由大到小的順序為________。
②在氨氣足量時,反應在催化劑A 作用下,經過相同時間,測得脫氮潮殖反應溫度的變化情況如圖乙所示,據圖可知,自相同的時間內,溫度對脫氮率的影響及可他的原因是________。(已知A、B催化劑在此溫度范圍內不失效)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中各微粒的濃度關系正確的是( )
A. 0.1mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
B. 0.1mol·L-1NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
C. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com