
【題目】某研究性學習小組為了解有機物A的性質,對A的結構進行了如下實驗。
實驗一:通過質譜分析儀分析得知有機物A的相對分子質量為90。
實驗二:用紅外光譜分析發(fā)現(xiàn)有機物A中含有-COOH和-OH。
實驗三:取1.8g有機物A完全燃燒后,測得生成物為2.64gCO2和1.08gH2O。
實驗四:經(jīng)核磁共振檢測發(fā)現(xiàn)有機物A的譜圖中H原子峰值比為3:1:1:1。
(1)有機物A的結構簡式為__。
(2)有機物A在一定條件下可以發(fā)生的反應有__。
a.消去反應 b.取代反應 c.聚合反應 d.加成反應 e.氧化反應
(3)有機物A在濃硫酸作用下可生成多種產(chǎn)物。其中一種產(chǎn)物B的分子式為C3H4O2,B能和溴發(fā)生加成反應,則B的結構簡式為__。另一種產(chǎn)物C是一種六元環(huán)狀酯,寫出生成C的化學方程式:__。
【答案】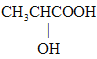 abce CH2=CHCOOH 2
abce CH2=CHCOOH 2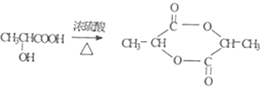 +2H2O
+2H2O
【解析】
(1)有機物A的相對分子質量為90,含有-COOH和-OH,那么只能有一個羧基,實驗三:取1.8g有機物A完全燃燒后,測得生成物為2.64gCO2和1.08gH2O,0.02molA完全燃燒后生成二氧化碳0.06molCO2和0.06mol H2O,所以碳原子的物質的量是0.06mol,氫原子的物質的量是0.12mol,所以有機物分子中碳原子個數(shù)是3,氫原子個數(shù)是6,根據(jù)相對分子質量是90,所以氧原子個數(shù)是3,即分子式為C3H6O2,實驗四:經(jīng)核磁共振檢測發(fā)現(xiàn)有機物A的譜圖中H原子峰值比為3:1:1:1,分子里有四種不同的氫原子,且數(shù)目比為為3:1:1:1,則A為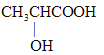 ;
;
(2)A在一定條件下可以發(fā)生的反應類型由官能團決定;
(3)A為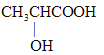 ,在濃硫酸作用下可生成一種產(chǎn)物B的分子式為C3H4O2,這是濃硫酸作用下的消去反應,生成碳碳雙鍵,B是丙烯酸, A在濃硫酸作用下可生成一種產(chǎn)物C是一種六元環(huán)狀酯,應是2分子A之間反應生成,據(jù)此寫反應方程式;
,在濃硫酸作用下可生成一種產(chǎn)物B的分子式為C3H4O2,這是濃硫酸作用下的消去反應,生成碳碳雙鍵,B是丙烯酸, A在濃硫酸作用下可生成一種產(chǎn)物C是一種六元環(huán)狀酯,應是2分子A之間反應生成,據(jù)此寫反應方程式;
(1)據(jù)上分析可知有機物A的結構簡式為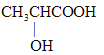 ;
;
答案為: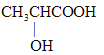 ;
;
(2)有機物A含有-COOH和-OH,在一定條件下-COOH和-OH即可以酯化反應,酯化反應屬于取代反應,又可以縮聚成聚乳酸,羥基還可以發(fā)生可以發(fā)生消去反應和氧化反應;
答案為:a b c e;
(3)B的分子式為C3H4O2,B能和溴發(fā)生加成反應,是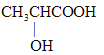 在濃硫酸作用下消去反應生成的產(chǎn)物,其中一種產(chǎn)物,則B的結構簡式為CH2=CHCOOH;
在濃硫酸作用下消去反應生成的產(chǎn)物,其中一種產(chǎn)物,則B的結構簡式為CH2=CHCOOH;
答案為:CH2=CHCOOH;
A在濃硫酸作用下可生成一種產(chǎn)物C是一種六元環(huán)狀酯,是一個A分子的羧基和另一個A分子的羥基之間發(fā)生酯化反應形成的,生成C的化學方程式為:
 ;
;
答案為: 。
。


科目:高中化學 來源: 題型:
【題目】某研究性學習小組探究FeSO4的化學性質和用途。回答下列問題:
(一) 探究FeSO4溶液的酸堿性:
(1)取少量FeSO4固體,利用石蕊試液測試FeSO4溶液的酸堿性,必須選用的儀器有膠頭滴管、藥匙和_____________。
A.玻璃棒 B.試管 C.天平 D.量筒
(二)利用下圖裝置探究FeSO4的穩(wěn)定性
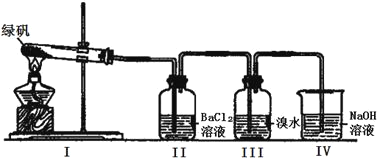
(2)II中有白色沉淀生成,小組成員結合理論分析,認為下列分解產(chǎn)物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用來檢驗是否有SO2氣體生成,若有SO2生成,溴水將褪色。實驗中,觀察到溴水褪色,據(jù)此推測FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2氣體,請寫出最大量吸收SO2氣體的反應化學方程式:_________。
(三)探究FeSO4中Fe2+還原性:
(5)證明FeSO4有較強的還原性,完成下表。
實驗步驟 | 實驗預期現(xiàn)象及結論 |
步驟一:取少量的FeSO4固體于試管中,加入一定量水溶解。 |
_________________________ |
步驟二:______________ |
(四)硫酸亞鐵用途探究
(6)缺鐵性貧血往往口服硫酸亞鐵,當用硫酸亞鐵制成藥片時,外表包有一層特殊的糖衣,其作用是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項中所示物質間的轉化均能實現(xiàn)的是( )
A.CH3CH2CH2Br![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.NaOH(aq)![]() C6H5ONa(aq)
C6H5ONa(aq)![]() NaHCO3(aq)
NaHCO3(aq)
C.NaOH(aq)![]() Cu(OH)2渾濁液
Cu(OH)2渾濁液![]() Cu2O(s)
Cu2O(s)
D.石油![]() CH3CH=CH2
CH3CH=CH2![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數(shù)與溫度的關系如圖所示。已知:氣體分壓(p分)=氣體總壓(p總)×體積分數(shù)。下列說法正確的是( )
2CO(g)。平衡時,體系中氣體體積分數(shù)與溫度的關系如圖所示。已知:氣體分壓(p分)=氣體總壓(p總)×體積分數(shù)。下列說法正確的是( )
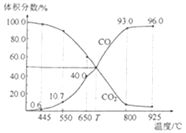
A.550℃時,若充入稀有氣體,v正、v逆均減小,平衡不移動
B.T℃時,反應達平衡后CO2的轉化率為50%
C.T℃時,若充入等體積的CO2和CO,平衡不移動
D.925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數(shù)Kp=24.0p總
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗不能達到預期目的是( )
實驗操作 | 實驗目的 | |
A | 充滿NO2的密閉玻璃球分別浸泡在冷、熱水中 | 研究溫度對化學平衡移動的影響 |
B | 向盛有1mL硝酸銀溶液的試管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 說明一種沉淀能轉化為另一種溶解度更小的沉淀 |
C | 苯酚和水的濁液中,加少量濃碳酸鈉溶液 | 比較苯酚與碳酸氫鈉的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,觀察是否出現(xiàn)白色渾濁 | 確定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素金屬性、非金屬性的說法正確的是( )
A.![]() 的酸性強于
的酸性強于![]() ,故非金屬性:
,故非金屬性:![]()
B.第ⅠA族金屬元素是同周期中金屬性最強的元素
C.僅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,無法驗證
溶液,無法驗證![]() 、
、![]() 的金屬性強弱
的金屬性強弱
D.第ⅦA族元素的陰離子還原性越強,其最高價氧化物對應水化物的酸性越強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.同一原子中,![]() 、
、![]() 、
、![]() 電子的能量逐漸減小
電子的能量逐漸減小
B.同一原子中,![]() 上的電子較
上的電子較![]() 上的電子離核遠
上的電子離核遠
C.能量高的電子在離核近的區(qū)域運動,能量低的電子在離線遠的區(qū)域運動
D.各能層含有的能級數(shù)為![]() (
(![]() 為能層序數(shù))
為能層序數(shù))
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙炔為原料在不同條件下可以合成多種有機物.
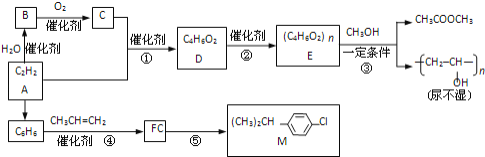
已知:①CH2=CHOH(不穩(wěn)定)![]() CH3CHO
CH3CHO
②一定條件下,醇與酯會發(fā)生交換反應:RCOOR’+R”O(jiān)H![]() RCOOR”+R’OH
RCOOR”+R’OH
完成下列填空:
(1)寫反應類型:③__反應;④__反應.反應⑤的反應條件__.
(2)寫出反應方程式.B生成C__;反應②__.
(3)R是M的同系物,其化學式為![]() ,則R有__種.
,則R有__種.
(4)寫出含碳碳雙鍵、能發(fā)生銀鏡反應且屬于酯的D的同分異構體的結構簡式__.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,2L密閉容器中,金屬鈉和CO2可制得金剛石:4Na+3CO22Na2CO3+C(s,金剛石)。
(1)上述反應中涉及的元素原子的半徑從大到小的順序為:___。
(2)能證明碳元素與氧元素非金屬性強弱的事實是___(選填編號)。
a.最高價氧化物水化物的酸性 b.兩種元素的氣態(tài)氫化物的沸點
c.CO2中元素的化合價 d.與氫氣反應的難易程度
(3)高壓下,科學家成功地將CO2轉化為具有類似SiO2結構的原子晶體,比較兩種原子晶體的熔沸點:___,并說明理由:___。除了金剛石外,碳的單質還有許多同素異形體,比如石墨、C60等。石墨烯是由碳原子構成的單層片狀結構的新材料,可由石墨剝離而成,是目前發(fā)現(xiàn)的最薄、強度最大、導電導熱性能最強的一種新材料。
(4)石墨烯中的碳原子間以___鍵結合,下列關于石墨烯的敘述正確的是___。
A.石墨烯與石墨屬于同位素
B.石墨烯與石墨完全燃燒的產(chǎn)物都是二氧化碳
C.石墨烯是一種烯烴。
D.12g石墨烯中含有6.02×1022個碳原子
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com