
【題目】Ⅰ.下面列出了幾組物質,請將物質的合適序號填寫在空格上。
①金剛石和石墨 ②D和T ③12C和13C ④O2和O3
⑤CH4和CH3CH2CH3 ⑥CH2=CHCH3和CH2=CH2
⑦CH3CH(CH3)CH2CH3和CH3(CH2)3CH3 ⑧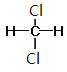 和
和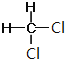
同系物____________;同分異構體____________。
Ⅱ.籃烷分子的鍵線式如圖所示,試回答:
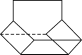
籃烷的一氯代物的種數為________種(不考慮立體異構)。
Ⅲ.在一定溫度下,體積為2 L的恒容密閉容器中,NO2和N2O4之間發生反應2NO2(g) ![]() N2O4(g),如圖所示。
N2O4(g),如圖所示。
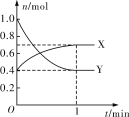
(1)曲線____________ (填“X”或“Y”)表示NO2的物質的量隨時間的變化曲線。
(2)該反應達到限度時,Y的轉化率是__________,反應開始時與反應達到平衡狀態時的壓強之比為__________。
【答案】 ⑤⑥ ⑦ 4 Y 60% 14∶11
【解析】Ⅰ.根據同系物和同分異構體的概念分析判斷;
Ⅱ.根據等效氫判斷一氯代物數目;
Ⅲ.(1)根據物質的量的變化量之比等于計量數之比分析;(2)根據v=![]() 計算反應速率;根據在相同條件下,氣體的壓強之比等于物質的量之比計算。
計算反應速率;根據在相同條件下,氣體的壓強之比等于物質的量之比計算。
Ⅰ. ①金剛石和石墨是同素異形體;②D和T屬于同位素;③12C和13C屬于同位素;④O2和O3是同素異形體;⑤CH4和CH3CH2CH3的結構相似,組成上相差2個CH2,是同系物;⑥CH2=CHCH3和CH2=CH2的結構相似,組成上相差1個CH2,是同系物;⑦CH3CH(CH3)CH2CH3和CH3(CH2)3CH3的分子式相同,結構不同,是同分異構體;⑧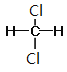 和
和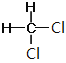 的結構相同,是同一種物質,因此屬于同系物的有⑤⑥;屬于同分異構體的有⑦,故答案為:⑤⑥;⑦;
的結構相同,是同一種物質,因此屬于同系物的有⑤⑥;屬于同分異構體的有⑦,故答案為:⑤⑥;⑦;
Ⅱ.該有機物分子屬于高度對稱結構,有如圖所示: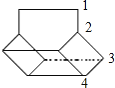 的4種H原子,則其一氯代物有4種,故答案為:4;
的4種H原子,則其一氯代物有4種,故答案為:4;
Ⅲ.(1)由方程式2NO2(g) ![]() N2O4(g) 可知,反應中NO2的物質的量變化較大,則Y表示NO2的物質的量隨時間的變化曲線,故答案為:Y;
N2O4(g) 可知,反應中NO2的物質的量變化較大,則Y表示NO2的物質的量隨時間的變化曲線,故答案為:Y;
(2)該反應達最大限度時,Y的轉化率為![]() ×100%=60%,開始時:n(X)+n(Y)=0.4mol+1mol=1.4mol,平衡時:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,在相同條件下,氣體的壓強之比等于物質的量之比,則反應開始時與反應達平衡狀態時的壓強之比為1.4mol:1.1mol=14:11,故答案為: 60%;14:11。
×100%=60%,開始時:n(X)+n(Y)=0.4mol+1mol=1.4mol,平衡時:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,在相同條件下,氣體的壓強之比等于物質的量之比,則反應開始時與反應達平衡狀態時的壓強之比為1.4mol:1.1mol=14:11,故答案為: 60%;14:11。


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】下列關于元素周期律和周期表的描述,正確的是( )
A. 在元素周期表的右上方可以尋找制取半導體的元素
B. 元素的性質隨著原子序數的增加而呈周期性變化
C. 俄國化學家門捷列夫是通過實驗的方法建立元素周期表的
D. 同一主族元素的原子從上到下,原子半徑減小,金屬性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用Cl2生產某些含氯有機物時會產生副產物HCl.利用反應A可實現氯的循環利用.反應A:4HCl+O2 ![]() 2Cl2+2H2O 已知:ⅰ.此條件下反應A中,4mol HCl被氧化,放出115.6kJ的熱量.
2Cl2+2H2O 已知:ⅰ.此條件下反應A中,4mol HCl被氧化,放出115.6kJ的熱量.
ⅱ. ![]()
①寫出此條件下,反應A的熱化學方程式 .
②斷開1mol H﹣O鍵與斷開1mol H﹣Cl鍵所需能量相差約為kJ.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯可被臭氧分解,發生化學反應![]() ,二甲苯通過上述反應可能的產物為
,二甲苯通過上述反應可能的產物為![]() ,若鄰二甲苯進行上述反應,對其反應產物描述正確的是
,若鄰二甲苯進行上述反應,對其反應產物描述正確的是
A. 產物為a、b、c,其分子個數比為a∶b∶c=1∶2∶3
B. 產物為a、b、c,其分子個數比為a∶b∶c=1∶2∶1
C. 產物為a和c,其分子個數比為a∶c=1∶2
D. 產物為b和c,其分子個數比為b∶c=2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香葉醇(D)是一種特殊的香料,也是一種重要的有機合成的原料。由香葉醇合成功能高分子L的合成路線如下:
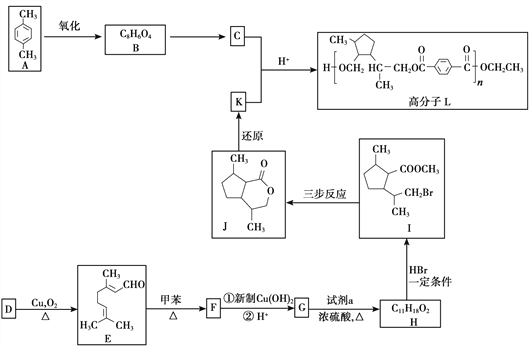
已知:
Ⅰ.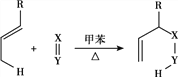 (R代表烴基,X=Y代表C=C、C=O等不飽和鍵,可與其他基團相連)
(R代表烴基,X=Y代表C=C、C=O等不飽和鍵,可與其他基團相連)
Ⅱ.![]()
(1)A的名稱是__________。
(2)B的結構簡式是__________。
(3)D中官能團的名稱是__________。
(4)試劑a是__________。
(5)由H得到I的反應類型是__________。
(6)由E生成F的化學方程式是__________。
(7)由I合成J需經歷三步反應,其中第一步、第三步的化學方程式分別是
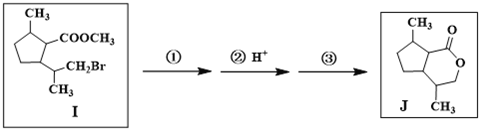
第一步:_______________________________________________
第三步:_______________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在強酸性溶液中,能大量共存的無色透明離子組是( )
A.K+、Na+、NO3-、Cu2+B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Br-、OH-D.Na+、Ba2+、Zn2+、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用廢棄舊電池的銅帽(Zn、Cu總含量約為99%)回收銅并制備ZnO的部分實驗過程如圖: 
(1)①寫出銅帽溶解過程中銅發生反應的化學方程式 . ②銅帽溶解后需將溶液中過量H2O2除去.除去H2O2的簡便方法是 .
(2)為確定加入鋅灰(主要成分為Zn、ZnO,雜質為鐵及其氧化物)的量,實驗中需測定除去H2O2后溶液中Cu2+的含量.實驗操作為:準確量取一定體積的含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節pH至3~4,加入過量KI,用Na2S2O3標準溶液滴定至終點.上述過程中的離子方程式如下: 2Cu2++4I﹣=2CuI(白色)↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
①滴定選用的指示劑為 , 滴定終點觀察到的現象為 .
②若滴定前溶液中H2O2沒有除盡,所測得的Cu2+的含量將會(填“偏高”、“偏低”、“不變”).
(3)已知pH>11時Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0molL﹣1計算)
Fe3+ | Fe2+ | Zn2+ | |
開始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
實驗中可選用的試劑:30% H2O2、1.0molL﹣1HNO3、1.0molL﹣1 NaOH.
由回收銅后的濾液制備ZnO的實驗步驟依次為:
①向濾液中加入略過量 , 使其充分反應
②向反應后的溶液中滴加1.0moLL﹣1的NaOH溶液,調節溶液的pH范圍為;
③過濾;
④向濾液中滴加1.0moLL﹣1的氫氧化鈉,調節pH范圍為;
⑤過濾、洗滌、干燥
⑥900℃煅燒.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F為原子序數依次增大的前36號元素,其中只有兩種金屬元素。A與C同主族,B與E同主族;B與C能形成兩種常見化合物;C與F最外層只有1個電子,且內層均已排滿;基態D原子成對電子數是未成對電子數的4倍。
請問答下列問題:
(1)基態B原子的軌道表達式為______,其最高能級的電子云有_____個不同的伸展方向。
(2)B、C、E原子半徑由大到小的順序為_________(用元素符號表示)。
(3)D和E中第一電離能較大的是_______(填元素符號),原因為___________。
(4)A與B形成的最簡單化合物比A與E形成的最簡單化合物的熔點______(填“高“或“低”),原因為___________。
(5)D的最高價氧化物對應的水化物中,D原子的雜化軌道類型為______,已知該分子中除氫外其他原子均滿足最外層8電子穩定結構,則其結構式為________。
(6)單質F及其同族元素P、Q的堆積模型均為面心立方最密堆積,三種原子的半徑分別為128pm、144pm、144pm,其中P和Q的相對原子質量分別為Mτ(P)、Mτ(Q)。
①單質F中的配位數為______;密度為_____g/cm3(用NA表示阿伏加德羅常數的值,列式即可)。
②單質P和Q的密度之比為________[用含Mτ(P)、Mτ(Q)的代數式表示]。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com