
【題目】如圖中化合物B既能使溴水褪色,又能溶解碳酸鈣,D、E均為高分子化合物。根據下圖填空:

(1)寫出葡萄糖與新制氫氧化銅濁液反應的化學方程式:_____。
(2)A中的官能團有_____(寫結構簡式)。
(3)E在自然界中可降解,對環境無害,下列說法正確的是___。
A.由A生成E的反應屬于加聚反應
B.E的相對分子質量為72
C.E用作一次性快餐盒有助于減少白色污染
(4)在反應①-⑤中,屬于取代反應的是_____。寫出D和F的結構簡式:D_______,F_______。
(5)A跟氫氧化鈣作用可制得一種常用的人體補鈣劑,測得這種補鈣劑的純凈物中鈣元素的質量分數為13.0%,其結晶水的含量為_____。
【答案】CH2OH(CHOH)4CHO+NaOH+2Cu(OH)2![]() CH2OH(CHOH)4COONa+Cu2O↓+3H2O -OH、-COOH C ②⑤
CH2OH(CHOH)4COONa+Cu2O↓+3H2O -OH、-COOH C ②⑤ ![]()
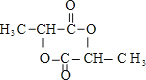 29.2%
29.2%
【解析】
葡萄糖在乳酸菌作用下生成乳酸,A為![]() ,乳酸通過縮聚反應生成高分子化合物E,化合物B既能使溴水褪色,又能溶解碳酸鈣,說明B為CH2=CHCOOH,A→B為消去反應,B與甲醇發生酯化反應生成的C為CH2=CHCOOCH3,C發生加聚反應生成高分子化合物D,乳酸通過分子間酯化生成環狀化合物F。
,乳酸通過縮聚反應生成高分子化合物E,化合物B既能使溴水褪色,又能溶解碳酸鈣,說明B為CH2=CHCOOH,A→B為消去反應,B與甲醇發生酯化反應生成的C為CH2=CHCOOCH3,C發生加聚反應生成高分子化合物D,乳酸通過分子間酯化生成環狀化合物F。
(1)葡萄糖中含有醛基,能夠被新制氫氧化銅氧化為羧基,化學方程式為CH2OH(CHOH)4CHO+NaOH+2Cu(OH)2![]() CH2OH(CHOH)4COONa+Cu2O↓+3H2O;
CH2OH(CHOH)4COONa+Cu2O↓+3H2O;
(2)葡萄糖在乳酸菌作用下生成乳酸,A為![]() ,含有羥基和羧基,結構簡式為-OH、-COOH;
,含有羥基和羧基,結構簡式為-OH、-COOH;
(3)乳酸通過縮聚反應生成高分子化合物E,E在自然界中可降解,對環境無害,E是高分子化合物,相對分子質量一定不是72,所以C正確,AB錯誤,故選:C;
(4)反應①為消去反應,②酯化反應即取代反應,③為加聚反應,化學方程式為nCH2=CHCOOCH3![]()
![]() ,④為縮聚反應,⑤為酯化反應即取代反應,反應方程式為2
,④為縮聚反應,⑤為酯化反應即取代反應,反應方程式為2![]()
![]()
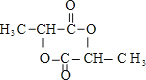 +2H2O,屬于取代反應的是②⑤;D、F的結構簡式分別是
+2H2O,屬于取代反應的是②⑤;D、F的結構簡式分別是![]() 、
、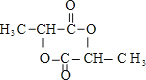 ;
;
(5)設乳酸鈣中水的含量為x,則其分子式為CaC6H10O6·xH2O,鈣元素的質量分數為13.0%,則有40/(40+12×6+1×10+16×6+18x)×100%=13%,x=5,其結晶水的含量為5×18/(40+12×6+1×10+16×6+5×18)×100%=29.2%。


科目:高中化學 來源: 題型:
【題目】H是合成抗炎藥洛索洛芬鈉的關鍵中間體,它的一種合成路線如下:

回答下列問題:
(1)A的名稱是____,H中官能團名稱是____;
(2)反應①的反應條件為____;
(3)反應⑥的化學方程式為________;反應類型為____。
(4)反應⑦除生成H外,還生成了另一種有機產物的結構簡式為____。
(5)符合下列條件的G的同分異構體有____種。
I.能發生銀鏡反應 Ⅱ.苯環上一氯取代物只有一種 Ⅲ.核磁共振氫譜有4組峰
(6)仿照H的合成路線,設計一種由B合成![]() 的合成路線___。
的合成路線___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物麻黃堿和牛磺酸的結構簡式如圖。有關麻黃堿、牛磺酸的敘述正確的是
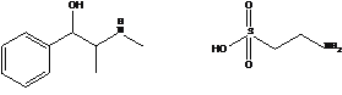
麻黃堿 牛磺酸
A.分子式分別為 C10H16ON、C2H7NO2S
B.均能發生取代反應,麻黃堿還能發生加成反應
C.均能與金屬鈉及氫氧化鈉溶液反應
D.牛磺酸與HSCH2CH( NH2)COOH( 半胱氨酸) 互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g)。根據已知信息回答下列問題:
(1)已知:P和Cl2分兩步反應生成1mol PCl5的熱化學方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反應生成1molPCl5的△H3=______________ kJ/mol。
②工業上制備PCl5通常也分兩步進行,通常將P和Cl2反應生成中間產物PCl3,然后降溫,再和Cl2反應生成PCl5,原因是____________________________________________。
③PCl5與足量水充分反應,最終生成兩種酸,其中一種是P的最高價含氧酸,其化學方程
式是________________________________________________________。
(2)反應PCl3(g)+Cl2(g)![]() PCl5(g)在容積為10L的密閉容器中進行。起始時PCl3和Cl2均為0.2mol,反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示。
PCl5(g)在容積為10L的密閉容器中進行。起始時PCl3和Cl2均為0.2mol,反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示。
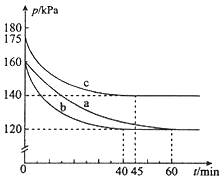
溫馨提示:同溫同容下的氣體,壓強之比就等于物質的量之比
①已知實驗b平衡時氣體的總物質的量為0.30mol,計算實驗b反應開始至達到平衡時的反應速率v(PCl5)=_______________,PCl3的平衡轉化率為__________________。
②圖中3組實驗從反應開始至達到平衡時的反應速率v(PCl5)由小到大的次序為____(填實驗序號);與實驗a相比,c組改變的實驗條件是升高溫度,判斷依據是_________,若α表示PCl3的平衡轉化率,實驗a和c的平衡轉化率:αa______αc(填“<”或“>”);b組改變的實驗條件是加入了催化劑,判斷依據是_______________________________。
③用p0表示開始時總壓強,p表示平衡時總壓強,則α(表示PCl3的平衡轉化率)的表達式為____(用p0,p表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家開發設計一種天然氣脫硫裝置,利用如右圖裝置可實現:H2S+O2→H2O2 +S。已知甲池中有如下的轉化:


下列說法錯誤的是:
A. 該裝置可將光能轉化為電能和化學能
B. 該裝置工作時,溶液中的H+從甲池經過全氟磺酸膜進入乙池
C. 甲池碳棒上發生電極反應:AQ+2H+ +2e- =H2AQ
D. 乙池①處發生反應:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維生素C又叫抗壞血酸,是一種水溶性維生素,只含有C、H、O三種元素,其球棍模型如圖所示。下列關于維生素C的說法正確的是( )
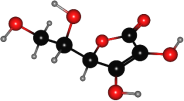
A.維生素C的分子式C6H8O6
B.維生素C含有1個手性碳原子
C.維生素C不能使溴水褪色
D.1mol維生素C與足量的鈉反應能產生2molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎的學科,實驗探究能激發學生學習化學的興趣。某化學興趣小組設計如圖實驗裝置(夾持設備已略)制備氯氣并探究氯氣及其鹵族元素的性質。回答下列問題:

(1)儀器a的名稱是______________。
(2)A裝置中發生的化學反應方程式為_________________________________。若將漂白粉換成KClO3,則反應中每生成21.3g Cl2時轉移的電子數目為____NA。
(3)裝置B可用于監測實驗過程中C處是否堵塞,若C處發生了堵塞,則B中可觀察到__________。
(4)裝置C的實驗目的是驗證氯氣是否具有漂白性,此時C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填選項a或b或c)。
選項 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布條 | 濃硫酸 | 濕潤的有色布條 |
b | 濕潤的有色布條 | 無水氯化鈣 | 干燥的有色布條 |
c | 濕潤的有色布條 | 堿石灰 | 干燥的有色布條 |
(5)設計裝置D、E的目的是比較氯、溴、碘的非金屬性。當向D中緩緩通入足量氯氣時,可觀察到無色溶液逐漸變為紅棕色,說明氯的非金屬性大于溴,打開活塞,將D中少量溶液加入E中,振蕩E,觀察到的現象是_______________________________,該現象_____(填“能”或“不能”)說明溴的非金屬性強于碘,原因是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用分類和氧化還原反應的知識能實現物質的轉化。
(1)請從下列試劑中選擇合適的完成指定轉化(試劑可以重復選擇)。
試劑:濃硫酸、I2、NaOH、NaCl、HCl
①HBr→Br2的化學方程式:___;
②V2O5(酸性氧化物)→VO![]() 的離子方程式:___。
的離子方程式:___。
(2)利用含碘酸性廢水(其中碘主要以IO![]() 形式存在)為原料生產CuI,其流程如圖:
形式存在)為原料生產CuI,其流程如圖:

①寫出“反應Ⅰ”的離子方程式為___;
②寫出“反應Ⅱ”的離子方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦(Ti)被譽為“21世紀的金屬”,工業上將TiO2與焦炭混合,通入Cl2高溫下制得TiCl4;再將TiCl4提純后,在氬氣保護下與鎂高溫反應制得Ti。其反應如下:
①TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
回答下列問題:
(1)Ti元素原子的價電子排布式為____________________;
(2)寫出與CO互為等電子體的分子_________________;
(3)已知TiCl4在通常情況下是無色液體,熔點為-37℃,沸點為136℃;TiCl4在潮濕空氣中易水解產生白霧,同時產生H2TiO3固體.
①TiCl4為______化合物(填“離子”或“共價”);
②TiCl4分子為正四面體形,則Ti為___________雜化.
③TiCl4在潮濕空氣中水解的化學方程式是____________________;
④TiCl2、Cl2和C反應制得的TiCl4最好的提純方法是__________(填操作名稱)。
(4)配離子[TiCl(H2O)5]2+的中心離子化合價為_______,中心離子配位數為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com