
【題目】某溫度時,在容積為2 L的密閉容器中,A、B、C三種氣態物質的物質的量隨時間變化的曲線如圖所示。
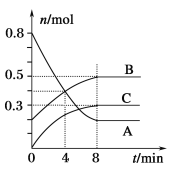
分析圖中數據,回答下列問題:
(1)該反應的化學方程式為______________。
(2)反應開始至4 min時,物質A的平均反應速率為____。
(3)4 min時,正反應速率_______(填“>”“<”或“=”,下同)逆反應速率,8 min時,正反應速率________逆反應速率。
【答案】2A(g) B(g) +C(g) 0.15mol/(Lmin) > =
【解析】
(1)由圖可知,8min末達到平衡狀態,說明該反應為可逆反應,從反應開始到8min末,A的物質的量減少0.6mol、B的物質的量增加0.3mol,C的物質的量增加0.3mol,
因此該反應的化學方程式為2A(g) B(g) +C(g);
(2)反應開始至4min末,A的物質的量減少了0.6mol,v(A)=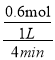 =0.15mol/(Lmin);
=0.15mol/(Lmin);
(3)4min的時候反應物的濃度仍然再繼續減少,所以反應向正反應方向進行,即v(正)>v(逆)。8 min時,物質的濃度不再發生變化,反應達到平衡狀態,所以v(正)=v(逆)。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中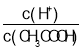 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】BaSO4在醫療上可作鋇餐,高溫煅燒BaSO4部分反應如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
則:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五氧化二碘(I2O5)可用作氧化劑,除去空氣中的一氧化碳,易溶于水形成碘酸,不溶于無水乙醇、乙醚、氯仿和二硫化碳。用下列裝置制備五氧化二碘(加熱裝置及夾持裝置省略)。

制備五氧化二碘的步驟如下:
步驟1:I2與KClO3按一定比例加入反應器M中,用硝酸調節pH=1~2,溫度控制在80~90℃,攪拌反應1h,使反應完全。
步驟2:然后冷卻至室溫,析出碘酸氫鉀晶體。將過濾得到的晶體加水、加熱溶解,并用足量氫氧化鉀溶液中和至溶液pH為10。再冷卻結晶,過濾得到的晶體于118℃干燥3h,得到碘酸鉀產品。
步驟3:將步驟2制得的碘酸鉀酸化后得碘酸(HIO3),再將碘酸在干燥空氣氣流中加熱到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空氣中的一氧化碳,反應生成碘單質,該反應中氧化劑與還原劑的物質的量之比為___。
(2)儀器M的名稱是___。
(3)步驟1中除了生成碘酸氫鉀[KH(IO3)2]外,同時還生成氯化鉀和氯氣,若n(KCl):n(C12)=5:3,寫出該反應的化學方程式:___,該反應中的氧化劑是___(填化學式)。
(4)反扣的漏斗N除了可以防止倒吸,還有一個作用是____,NaOH溶液的作用是___。
(5)步驟2中的主要反應為KH(IO3)2+KOH===2KIO3+H2O,稱取0.550g碘酸鉀產品(假設雜質不參與反應),將產品放入燒杯中,加蒸餾水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于錐形瓶中并加入指示劑,然后用0.1mol·L-1 Na2S2O3標準溶液滴定至終點,三次實驗平均消耗標準溶液的體積為15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①該滴定選擇的指示劑是_____。
②該碘酸鉀產品中碘酸鉀的質量分數是____%(保留三位有效數字)。
③若裝Na2S2O3標準溶液的滴定管沒有用Na2S2O3標準溶液潤洗,則所測得產品的質量分數___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列敘述的方法中,能將有機化合物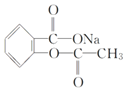 轉變為
轉變為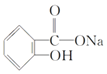 的有( )
的有( )
A.跟足量的NaOH溶液共熱后,再通入二氧化碳直至過量
B.把溶液充分加熱后,通入足量的二氧化硫
C.與稀H2SO4共熱后,加入足量NaOH溶液
D.與稀H2SO4共熱后,加入足量NaHCO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向500mLNaOH溶液中投入10.8g的鋁,二者恰好完全反應,試計算:
(1)求鋁的物質的量___;
(2)參加反應的氫氧化鈉的物質的量___和物質的量濃度___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
A. 中子數為18的氯原子:![]()
B. N2的結構式:N=N
C. Na+的結構示意圖: 
D. H2O的電子式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了三位為鋰離子電池發展作出重要貢獻的科學家。鈷酸鋰(LiCoO2)電池的工作原理如圖所示,其中A極材料是金屬鋰和石墨的復合材料(石墨作金屬鋰的載體),電解質為一種能傳導Li+的高分子材料,隔膜只允許特定的離子通過。電池反應式為: LixC6+ Li1-xCoO2![]() C6+LiCoO2。下列說法中正確的是
C6+LiCoO2。下列說法中正確的是
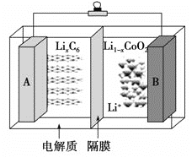
A.充電時Li由B極區域移向A極區域
B.充電時,A為陰極,發生氧化反應C6+xLi++xe-=LixC6
C.放電時,B為正極,電極反應式為Li1-xCoO2+xLi++xe-=LiCoO2
D.廢舊鈷酸鋰(LiCoO2)電池進行“放電處理”使鋰進入石墨中而有利于回收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用化學平衡移動原理解釋的是
A.新制氯水長時間放置顏色變淺
B.高壓比常壓更有利于 SO2 轉化為 SO3
C.蒸干 AlCl3 溶液無法得到無水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 與稀 H2SO4 反應的速率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com