
【題目】青海昆侖玉被定為08北京奧運會獎牌用玉,昆侖玉主要成分是由“透閃石”和“陽起石”組成的纖維狀微晶結合體,透閃石(Tremolite)的化學成份為Ca2Mg5Si8O22(OH)2。下列有關說法不正確的是
A.透閃石的化學式寫成氧化物的形式為:2CaO·5MgO·8SiO2·H2O
B.透閃石的化學式寫成硅酸鹽的形式為:2CaSiO3·5MgSiO3·H2SiO3
C.透閃石中Mg元素的質量分數是Ca元素質量分數的2倍
D.透閃石中還可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等。
【答案】C
【解析】
硅酸鹽改寫原則為:活潑的金屬氧化物—不活潑的金屬氧化物—二氧化硅—水,改寫過程要遵循原子守恒,據此進行分析。
A.根據硅酸鹽改寫原則及原子守恒規律可知,Ca2Mg5Si8O22(OH)2寫成氧化物的形式為:2CaO·5MgO·8SiO2·H2O,故A正確;
B.根據原子守恒及化合價不變規律,透閃石(Ca2Mg5Si8O22(OH)2)的化學式寫成硅酸鹽的形式為:2CaSiO3·5MgSiO3·H2SiO3,故B正確;
C.透閃石中Mg元素的質量分數是![]() ×100%,Ca元素質量分數是
×100%,Ca元素質量分數是![]() ×100%,所以Mg元素的質量分數:Ca元素質量分數=3:4,Mg元素的質量分數是Ca元素質量分數的0.75倍,故C錯誤;
×100%,所以Mg元素的質量分數:Ca元素質量分數=3:4,Mg元素的質量分數是Ca元素質量分數的0.75倍,故C錯誤;
D.透閃石中還可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等,故D正確;
故答案選C。


 孟建平錯題本系列答案
孟建平錯題本系列答案 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增大,W原子的最外層電子數是其質子數的![]() ,X原子的核電荷數等于Z原子的最外層電子數,元素Y的最高正化合價為+2價。下列說法正確的是( )
,X原子的核電荷數等于Z原子的最外層電子數,元素Y的最高正化合價為+2價。下列說法正確的是( )
A.單質的沸點:W<X
B.簡單離子的半徑:Z>Y
C.X、Z的氧化物對應的水化物均為強酸
D.X、Y可形成離子化合物X3Y2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家正在研究溫室氣體CH4和CO2的轉化和利用。
(1)O原子核外電子的運動狀態有____種。
(2)CH4和CO2所含的三種元素電負性從小到大的順序為____。
(3)下列關于CH4和CO2的說法正確的是____(填序號)。
a.固態CO2屬于分子晶體,在晶體中一個CO2分子周圍有12個緊鄰的CO2分子
b.CH4分子中含有極性共價鍵,是極性分子
c.因為碳氫鍵鍵能小于碳氧鍵,所以CH4熔點低于CO2
d.CH4和CO2分子中碳原子的雜化類型分別是sp3和sp
(4)在Ni基催化劑作用下,CH4和CO2反應可獲得化工原料CO和H2
①基態Ni原子的電子排布式為____,該元素位于元素周期表的第____周期____族。
②Ni能與CO形成正四面體形的配合物Ni(CO)4,1mol Ni(CO)4中含有____mol σ鍵。
(5)一定條件下,CH4和CO2都能與H2O形成籠狀結構(如圖所示)的水合物晶體,其相關參數見下表。CH4與H2O形成的水合物俗稱“可燃冰”。
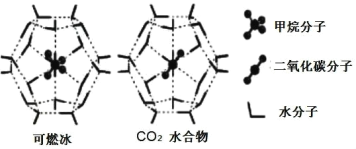
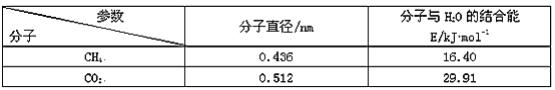
①“可燃冰”中分子間存在的2種作用力是____。
②為開采深海海底的“可燃冰”,有科學家提出用CO2置換CH4的設想。已知圖中籠狀結構的空腔直徑為0.586nm,根據上述圖表,從物質結構及性質的角度分析,該設想的依據是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. (CH3)3C-CH=CH2與氫氣完全反應后,生成2,2,3-三甲基戊烷
B. 工業上由乙烯制乙醇、苯制環己烷均屬于加成反應
C. C5H11Cl的同分異構體有3種
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備純硅反應的熱化學方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某溫度、壓強下,將一定量反應物通入密閉容器進行以上反應,下列敘述正確的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某溫度、壓強下,將一定量反應物通入密閉容器進行以上反應,下列敘述正確的是( )
A.反應過程中,若增大壓強能提高SiCl4的轉化率
B.若反應開始時SiCl4為1mol,則達平衡時,吸收熱量為QkJ
C.反應至4min時,若HCl濃度為0.12mol·L-1,則H2反應速率為0.03mol·L-1·min-1
D.當反應吸收熱量為0.025QkJ時,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2008年北京奧運會“祥云”奧運火炬所用環保型燃料為丙烷(C3H8),悉尼奧運會所用火炬燃料為65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol
異丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol
下列有關說法正確的是( )
A.常溫下,正丁烷的燃燒熱為-2878.0kJ/mol
B.相同質量的丙烷和正丁烷分別完全燃燒,前者需要的氧氣多產生的熱量也多
C.常溫下,CO的燃燒熱為566.0 kJ/mol
D.人類利用的能源都是通過化學反應獲得的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過反應“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”,能制得用于化學鍍鎳的NaH2PO2。P4的結構如圖所示,則下列說法正確的是
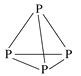
A.白磷中各P原子通過共價鍵相連接形成共價晶體
B.H2O分子的立體構型為V形
C.該反應能自發進行,則ΔS<0
D.反應產物PH3中磷原子的雜化方式為sp3雜化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷是天然氣的主要成分,是一種重要的清潔能源和化工原料。
(1)用煤制天然氣時會發生多個反應,通過多種途徑生成CH4。
已知:C(s)十2H2(g) ![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
2CO(g) ![]() C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
CO(g)十3H2(g) ![]() CH4(g)+H2O(g) △H=-203kJ/mol。
CH4(g)+H2O(g) △H=-203kJ/mol。
寫出CO(g) 與H2O(g) 反應生成H 2(g) 和CO2(g) 的熱化學方程式____________。
(2)天然氣中含有H2S雜質,某科研小組用氨水吸收得到NH4HS溶液,已知T℃k(NH3·H2O) =1.74×10-5; k1(H2S) =1.07×10-7, k2(H2S) =1.74×10-13,NH4HS溶液中所含粒子濃度大小關系正確的是____________。
A c(NH4+)>c(HS-)>c(OH-) >c(H+)
B c(HS-) > c(NH4+)> (S2-) >c(H+)
C c(NH4+)>c(HS-) >c(H2S) >c(H+)
D c(HS-) >c(S2-) >c(H+)>c(OH-)
(3)工業上常用CH4與水蒸氣在一定條件下來制取H2,其原理為: CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
①一定溫度時, 在一個體積為2L的恒容密閉容器中, 加入1molCH4和1.4mol水蒸氣發生上述反應, 5min后達平衡, 生成0.2mol CO, 用H2表示該反應的速率為____________。此反應的平衡常數為____________(結果保留到小數點后三位)。
②下列說法中能說明此反應達到平衡狀態的是____________。
A 體系的壓強不再發生變化
B 生成1molCH4的同時消耗3molH2
C 各組分的物質的量濃度不再改變
D 體系的密度不再發生變化
E 反應速率V(CH4):V(H2O):u(CO):u(H2)=1:1:1:3
(4)甲醇水蒸氣重整制氫反應:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某溫度下, 將[n(H2O) :n(CH3OH) ] =1:1的原料氣充入恒容密閉容器中,初始壓強為p1,反應達到平衡時總壓強為p2,則平衡時甲醇的轉化率為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.一般沉淀離子濃度小于10-5mol·L-1時,則認為已經沉淀完全
B.反應AgCl+NaBr=AgBr+NaCl能在水溶液中能進行,是因為AgCl比AgBr更難溶于水
C.Al(OH)3(s)![]() Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3![]() Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反應速率很高的化學反應才能應用于工業生產
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com