
【題目】氮氧化物、二氧化硫是造成大氣污染的主要物質,某科研小組進行如下研究。
(1)已知:
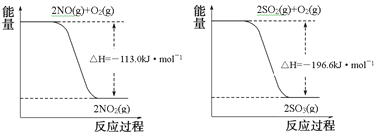
寫出SO2(g)與NO2(g)反應生成SO3(g)和NO(g)的熱化學方程式___________________。
(2)向容積為1L密閉容器中分別充入0.10molNO2和0.15mol SO2,在不同溫度下測定同一時刻NO2的轉化率,結果如圖所示。

①a、c兩點反應速率大小關系:υ(a)________υ(c)。(填“>”、“<”或“=”)
②溫度為T2時從反應開始經過2min達到b點,用SO3表示這段時間的反應速率為_____________,此溫度下該反應的平衡常數為____________,若在此溫度下,保持容器的容積不變,再向容器中充入0.20molNO2和0.30mol SO2,NO2的轉化率_________________。(填“增大”、“減小”或“不變”)
③NO2的轉化率隨溫度升高先增大后減小的原因是: ____________________。
(3)常溫下用NaOH溶液吸收SO2,在吸收過程中,溶液pH隨n(SO32―)∶n(HSO3―)變化關系如下表:
n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①當吸收液呈中性時,溶液中離子濃度由大到小排列順序為______________。
②當向NaOH溶液中通入足量的SO2時,得到NaHSO3溶液,在pH為4~7之間電解,硫元素在陰極上被還原為Na2S2O4,這是電化學脫硫技術之一,寫出該陰極的電極反應式_____________。
【答案】 SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1 < 0.025mol·L-1·min-1 0.5 不變 溫度為T2,b點為平衡點,T2以前溫度升高,反應速率加快,NO2轉化率增大,T2以后,該反應為放熱反應,升高溫度,平衡向逆反應方向移動,轉化率減小 c(Na+)> c(HSO3-) > c(SO32-) > c(H+)= c(OH-) 2HSO3-+2H++2e-=S2O42-+2H2O
【解析】(1)已知由圖分析得①2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol,②O2(g)+2NO(g)═2NO2(g);△H=-113.0kJ/mol,根據蓋斯定律![]() 可得:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol,故答案為:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol;
可得:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol,故答案為:SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol;
(2)①溫度越高化學反應速率越快,故υ(a)<υ(c),故答案為:<;
②n變(NO2)=0.1mol×50%=0.05mol
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
開始(mol/L) 0.15 0.1 0 0
變 (mol/L) 0.05 0.05 0.05 0.05
2min(mol/L) 0.1 0.05 0.05 0.05
v(SO3)= ![]() =
=![]() =0.025molL-1min-1;K=
=0.025molL-1min-1;K=![]() =
=![]() =0.5;α(NO2)=
=0.5;α(NO2)= ![]() ×100%=50%,
×100%=50%,
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
開始(mol/L) 0.4 0.25 0.05 0.05
變 (mol/L)x x x x
2min(mol/L)0.4-x 0.25-x 0.05+x 0.05+x,
因為溫度不變,故K不變,即![]() =0.5,解得x=0.125,故α(NO2)=
=0.5,解得x=0.125,故α(NO2)= ![]() ×100%=50%,故轉化率不變;故答案為:0.025molL-1min-1;0.5;不變;
×100%=50%,故轉化率不變;故答案為:0.025molL-1min-1;0.5;不變;
③NO2的轉化率隨溫度升高先增大后減小的原因是,溫度為T2,b點為平衡點,T2以前溫度升高,反應速率加快,NO2轉化率增大,T2以后,該反應為放熱反應,升高溫度,平衡向逆反應方向移動,轉化率減小,故答案為:溫度為T2,b點為平衡點,T2以前溫度升高,反應速率加快,NO2轉化率增大,T2以后,該反應為放熱反應,升高溫度,平衡向逆反應方向移動,轉化率減小;
(3)①SO32-+H2O![]() HSO3-+OH-,HSO3-
HSO3-+OH-,HSO3-![]() H++SO32-,亞硫酸兩步水解,第一步水解遠遠大于第二步水解,則離子濃度為c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故答案為:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
H++SO32-,亞硫酸兩步水解,第一步水解遠遠大于第二步水解,則離子濃度為c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故答案為:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
②據陰極得電子發生還原反應,故電極方程式為2HSO3-+2H++2e-=S2O42-+2H2O,故答案為:2HSO3-+2H++2e-=S2O42-+2H2O。


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】下列溶液中,溶質的物質的量濃度為1mol/L的是( )
A.將40gNaOH溶于1L水所得的溶液
B.將80g SO3溶于水并配成1L的溶液
C.將0.5mol/L的NaNO3溶液100mL加熱蒸發掉50g水的溶液
D.含K+為2mol的K2SO4溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是
A. 飽和NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
B. Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 無水AlCl3
無水AlCl3
C. H2SO4(濃) ![]() SO2
SO2![]() (NH4)2SO3(aq)
(NH4)2SO3(aq)
D. Cl2(g) ![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于堿金屬元素(M)的單質及其化合物說法不正確的是
A. 隨核電荷數遞增單質的熔點依次降低、硬度依次減小
B. 化合物中M的化合價均為+1價
C. 單質在空氣中都劇烈反應,生成M2O2
D. 隨核電荷數遞增單質與水反應的劇烈程度變強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是關于“外界因素對化學平衡移動影響的實驗研究”的課題,回答問題:
(1)影響化學平衡因素的界定:化學平衡發生移動的本質原因是________,所以影響化學平衡的因素可以從分析影響的因素入手.
a. v(正)≠v(逆) ![]() .v(正)和v(逆)都增大
.v(正)和v(逆)都增大 ![]() v(正)和v(逆)都減小
v(正)和v(逆)都減小
(2)研究的思路與方法
①研究對象的選擇,現有以下可逆反應:
![]() .
.![]()
![]() .
.![]()
其中,![]() 適合于研究_______對平衡的影響,
適合于研究_______對平衡的影響,![]() 適合于研究_______對平衡的影響.
適合于研究_______對平衡的影響.
![]() .濃度
.濃度![]() .溫度
.溫度![]() .壓強
.壓強![]() .催化劑
.催化劑
②研究方法:采用控制其他因素不變,改變其中一個因素的方法,并進行對比實驗.
(3)單一因素對化學平衡移動影響的實驗研究:
![]() .濃度:將
.濃度:將![]() 與
與![]() 反應后所得的混合液分為
反應后所得的混合液分為![]() 等份,分別加入濃
等份,分別加入濃![]() 溶液、濃
溶液、濃![]() 溶液和
溶液和![]() 固體,觀察現象.現象:加入濃
固體,觀察現象.現象:加入濃![]() 溶液后的混合溶液紅色________,加入
溶液后的混合溶液紅色________,加入![]() 固體后,混合溶液紅棕色________.
固體后,混合溶液紅棕色________.
![]() .溫度:將密封并相互連通的盛有
.溫度:將密封并相互連通的盛有![]() 的兩個玻璃球,一個放人熱水中,另一個放入冷水中.
的兩個玻璃球,一個放人熱水中,另一個放入冷水中.
現象:放入熱水中的球內紅棕色________;放入冷水中的球內紅棕色________.
(4)綜合(3)能得出的影響化學平衡移動的原因是________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】催化還原CO2是解決溫室效應及能源問題的重要手段之一,研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO,反應的熱化學方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某實驗室控制CO2和H2初始投料比為1︰2.2,在相同壓強下,經過相同反應時間測得如下實驗數據:
T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[備注]Cat.1:Cu/ZnO納米棒;Cat.2:Cu/ZnO納米片;甲醇選擇性:轉化的CO2中生成甲醇的百分比
已知:①CO和H2的標準燃燒熱分別為-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
請回答(不考慮溫度對△H的影響):
(1)反應I的平衡常數表達式K=______;反應II的△H2=______kJmol-1.
(2)有利于提高CO2轉化為CH3OH平衡轉化率的措施有__________。
A.使用催化劑Cat.1 B.使用催化劑Cat.2
C.降低反應溫度 D.投料比不變,增加反應物的濃度
E.增大 CO2和H2的初始投料比
(3)表中實驗數據表明,在相同溫度下不同的催化劑對CO2轉化成CH3OH的選擇性有顯著的影響,其原因是___________________________。
(4)在如圖中分別畫出反應I在無催化劑、有Cat.1和有Cat.2三種情況下“反應過程-能量”示意圖_________。

(5)研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應發生在______極,該電極反應式是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體硝酸鹽加熱易分解且產物較復雜。某學習小組以Mg(NO3)2為研究對象,擬通過實驗探究其熱分解的產物。
(1)實驗前,小組對Mg(NO3)2分解產物的組成提出如下4種猜想:
甲:MgO、NO2、O2乙:Mg(NO2)2、NO2、O2
丙:Mg3N2、O2丁:MgO、NO2、N2
不需要實驗驗證就認定猜想丁不成立,理由是___________________________。
(2)實驗過程
查閱資料得知2NO2+2NaOH=NaNO3+NaNO2+H2O,針對甲、乙、丙猜想,設計如下圖所示的實驗裝置(圖中加熱、夾持儀器等均省略):
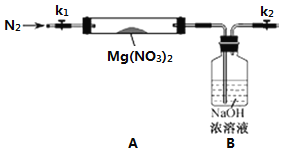
①檢查如上裝置氣密性應如何操作______________________。
②經檢驗裝置氣密性良好,稱取7.4 g Mg(NO3)2固體置于硬質玻璃管A中,并連接好上圖裝置。在用酒精燈給硬質玻璃管A加熱前,先進行的操作是__________。
③觀察到A中有紅棕色氣體出現。
④待樣品完全分解,A 裝置冷卻至室溫、稱量,測得剩余固體的質量為2.0g,通過計算確定該剩余固體的成分是__________(填化學式)。
(3)實驗結果分析討論
①某同學提出:取A中少量剩余固體于試管中,加入適量水,如未見明顯現象,也能直接排除甲、乙、丙中的一種猜想,判定依據是__________(用化學方程式表示)。
②根據以上分析可初步確認猜想_______(填甲、乙、丙)是正確的。
③為驗證產物中的O2,學習小組對實驗裝置進行了如下圖的改進,其中裝置B的作用是__________,裝置C的作用是_________,若D中出現________現象,說明產物中有O2。
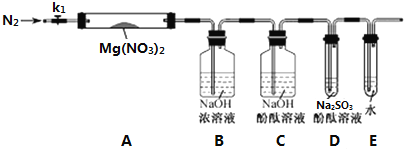
④小組同學用改進后的裝置重新實驗,卻發現D 中無明顯現象,但小組討論認定分解產物中仍有O2存在,未檢測到的原因是_______(用化學反應方程式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com