
【題目】化學實驗操作要遵循安全性和簡約性,如圖操作正確但不是從安全性方面考慮的操作是
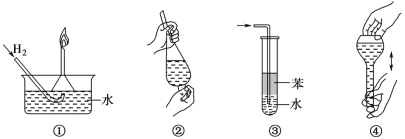
A.操作①:使用稍浸入液面下的倒扣漏斗檢驗氫氣的純度
B.操作②:使用CCl4萃取溴水中的溴時,振蕩后需打開活塞使漏斗內(nèi)氣體放出
C.操作③:吸收氨氣或氯化氫氣體并防止倒吸
D.操作④:配制一定物質(zhì)的量濃度溶液時的“搖勻”操作
 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】二氧化硫是大氣的主要污染物之一。催化還原SO2不僅可以消除SO2的污染,還可以得到工業(yè)原料S。燃煤煙氣中硫的回收反應為:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
則硫的回收反應的△H=___________ kJ·mol-1。
(2)其他條件相同、催化劑不同時,硫的回收反應中SO2的轉(zhuǎn)化率隨反應溫度的變化如圖所示。260℃時,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化劑均可能使SO2的轉(zhuǎn)化率達到很高,不考慮價格因素,選擇La2O3的主要優(yōu)點是___________。

(3)一定條件下,若在恒壓密閉容器中發(fā)生硫的回收反應,SO2的平衡轉(zhuǎn)化率與溫度、壓強的關系如圖所示,則P1、P2、P3、P4由大到小的順序為___________;某溫度下,若在恒容密閉容器中,初始時c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡轉(zhuǎn)化率為80%,則該溫度下反應的化學平衡常數(shù)為___________。
(4)某實驗小組為探究煙氣流速、溫度對該反應的影響,用La2O3作催化劑,分別在兩種不同煙氣流量、不同溫度下進行實驗。實驗結(jié)果顯示:在260℃時,SO2的轉(zhuǎn)化率隨煙氣流量增大而減小,其原因是___________;在380℃時,SO2的轉(zhuǎn)化率隨煙氣流量增大而增大,其原因是___________。
(5)工業(yè)上常用Na2SO3溶液吸收煙氣中的SO2,將煙氣通入1.0 mol·L-1的N2SO3溶液,當溶液pH約為6時,吸收SO2的能力顯著下降此時溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CH4燃燒后得到的產(chǎn)物是CO、CO2、H2O(g),此混合物的質(zhì)量為49.6 g,當其緩緩通過足量的無水CaCl2時氣體質(zhì)量減少25.2 g,則混合氣中CO的質(zhì)量為( )。
A. 24.4 gB. 13.2 gC. 12.5 gD. 11.2 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組欲探究含硫物質(zhì)的性質(zhì)及制備。
(探究一)選用下面的裝置和藥品探究亞硫酸與次氯酸的酸性強弱:
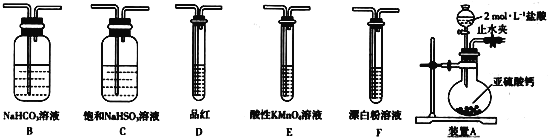
(1)裝置A中盛固體的玻璃儀器名稱是____,裝置A中反應的離子化學方程式為_________。
(2)裝置連接順序為A__________,其中裝置C的作用是_________,通過現(xiàn)象_______,即可證明亞硫酸的酸性強于次氯酸。
(探究二)硫代硫酸鈉晶體(Na2S2O3·5H2O,M=248g/mol)可用作定影劑、還原劑。回答下列問題:
(3)利用K2Cr2O7標準溶液定量測定硫代硫酸鈉的純度。測定步驟如下:
①溶液配制:稱取1.2000 g某硫代硫酸鈉晶體樣品,用新煮沸并冷卻的蒸餾水在燒杯中溶解,完全溶解后,全部轉(zhuǎn)移至100mL容量瓶中,再定容至凹液面與刻度線相平。
②滴定:取0.00950 mol·L1的K2Cr2O7標準溶液20.00 mL,硫酸酸化后加入過量KI,發(fā)生反應:Cr2O72+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸鈉樣品溶液滴定至淡黃綠色,發(fā)生反應:I2+2S2O32=S4O62+2I。加入淀粉溶液作為指示劑,繼續(xù)滴定,當______即為終點。平行滴定3次,樣品溶液的平均用量為24.80 mL,則樣品純度為______%(保留1位小數(shù))。
(4)Na2S2O3常用于脫氯劑,在溶液中易被氯氣氧化為SO42-,該反應的離子方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業(yè)的基本原料,其產(chǎn)量可以用來衡量一個國家的石油化工發(fā)展水平,A還是一種植物生長調(diào)節(jié)劑,A可發(fā)生如圖所示的一系列化學反應。根據(jù)如圖回答下列問題:

(1)寫出D的結(jié)構(gòu)簡式:____________________________。
(2)寫出②⑤兩步反應的化學方程式,并注明反應類型:
②__________________________________________________(反應類型____________)。
⑤__________________________________________________(反應類型____________)。
(3)利用反應①制備的B中常常還含有少量的A,在實驗室中如何除去B中含有的少量雜質(zhì)A:_________________________________________________(答試劑及操作方法)。
(4)某科研工作者以A為原料成功合成一種分子式為C6H14的物質(zhì)F,物質(zhì)F的可能結(jié)構(gòu)有_________種,物質(zhì)F與B的關系為___________________(選填A、B、C、D)。
A.同一種物質(zhì)B.互為同分構(gòu)體C.互為同系物D.互為同素異形體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數(shù),下列有關說法正確的是( )
A.用Fe、Cu和稀硫酸組成原電池,當負極質(zhì)量減輕5.6g時,通過溶液的電子為0.2NA
B.標準狀況下,2.24L三氯甲烷中含氫原子數(shù)為0.1NA
C.密閉容器中,2molSO2和1molO2充分反應后分子總數(shù)為2NA
D.11.6g丁烷中所含的非極性鍵數(shù)目為0.6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一學生用如圖裝置研究原電池原理,下列說法錯誤的是( )
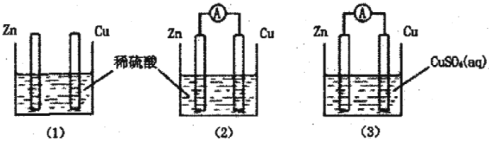
A.(2)圖中電子由Zn沿導線流向Cu
B.(3)圖中Zn片增重質(zhì)量與Cu棒減輕質(zhì)量比值為65∶64
C.(1)圖中銅棒上沒有氣體產(chǎn)生
D.(2)圖與(3)圖中正極生成物質(zhì)量比為1∶32時,Zn片減輕的質(zhì)量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,表中所列字母分別代表某一化學元素。
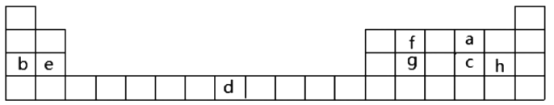
(1)表中字母h元素在周期表中位置___。
(2)寫出b元素的最高價氧化物對應的水化物所含化學鍵類型___。
(3)下列事實能說明a元素的非金屬性比c元素的非金屬性強的有___。
A.a單質(zhì)與c的氫化物溶液反應,溶液變渾濁
B.在氧化還原反應中,1mola單質(zhì)比1molc單質(zhì)得電子數(shù)目多
C.a和c兩元素的簡單氫化物受熱分解,前者的分解溫度高
(4)g與h兩元素的單質(zhì)反應生成1molg的最高價化合物。恢復至室溫,放熱687kJ。已知該化合物的熔、沸點分別為-69℃和58℃。寫出該反應的熱化學方程式___。
(5)常溫下d遇濃硫酸形成致密氧化膜,若薄膜為具有磁性的該元素氧化物,寫出該反應的化學方程式___。
(6)e與f形成的1mol化合物Q與水反應,生成2mol氫氧化物和1mol烴,該烴分子中碳氫質(zhì)量比為9∶1,寫出烴分子電子式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一氧化碳變換反應CO + H2O![]() CO2 + H2中,有關反應條件改變使反應速率增大的原因分析不正確的是
CO2 + H2中,有關反應條件改變使反應速率增大的原因分析不正確的是
A.使用催化劑,活化分子百分數(shù)增大,有效碰撞幾率增加
B.升高溫度,活化分子百分數(shù)增大,有效碰撞幾率增加
C.增大壓強,單位體積內(nèi)活化分子數(shù)增多,有效碰撞幾率增加
D.增大c(CO),活化分子百分數(shù)增大,有效碰撞幾率增加
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com