
【題目】莽草酸可用于合成藥物達菲,其結構簡式如圖,下列關于莽草酸的說法正確的是( )
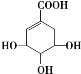
A.分子式為C7H10O5,屬于芳香族化合物,易溶于水
B.分子中含有3種官能團,可以發生加成、氧化、取代等反應
C.在水溶液中,1mol莽草酸最多可電離出4molH+
D.1mol莽草酸與足量的NaHCO3溶液反應可放出4molCO2氣體
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】如圖是一稀酸對Fe﹣Cr合金隨Cr含量變化的腐蝕性實驗結果,下列有關說法正確的是( )

A.稀硝酸對Fe﹣Cr合金的腐蝕性比稀硫酸和稀鹽酸的弱
B.稀硝酸和鐵反應的化學方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%時,因為三種酸中硫酸的氫離子濃度最大,所以對Fe﹣Cr合金的腐蝕性最強
D.隨著Cr含量增加,稀硝酸對Fe﹣Cr合金的腐蝕性減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知分解1mol H2O2放出熱量98kJ,在含少量I-的溶液中,H2O2分解的機理為:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有關該反應的說法正確的是( )
A.反應速率與I-濃度無關
B.IO-也是該反應的催化劑
C.分解2mol H2O2放出熱量196kJ
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】尼洛替尼用于治療白血病有顯著療效。有機化合物M(![]() )是合成尼洛替尼的中間體,其一種合成路線如圖:
)是合成尼洛替尼的中間體,其一種合成路線如圖:

已知:含有α—氫的酯在醇鈉等堿性縮合劑作用下發生縮合作用,失去一分子醇得到β—酮酸酯。如:
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
回答下列問題:
(1)有機物A中含氧官能團的名稱為___。
(2)M的分子中最多有___個碳原子在同一個平面上,M存在順反異構現象,其反式異構體的結構簡式是___。
(3)反應①的化學方程式為___;其反應類型為___。
(4)有機物![]() 有多種同分異構體,其中含有苯環的硝基化合物有___種,寫出其中一種具有手性碳的同分異構體的結構簡式為___。
有多種同分異構體,其中含有苯環的硝基化合物有___種,寫出其中一種具有手性碳的同分異構體的結構簡式為___。
(5)寫出以乙醇、乙酸、 為原料合成
為原料合成 的合成路線(其它試劑任選)___。
的合成路線(其它試劑任選)___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.1 mol·L-1NaOH溶液分別滴定20.00mL 0.1 mol·L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法正確的是
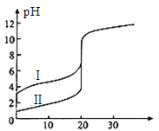
A.Ⅰ、Ⅱ分別表示鹽酸和醋酸的滴定曲線
B.pH=7時,滴定鹽酸和醋酸消耗NaOH溶液的體積相等
C.V(NaOH)=10.00mL時,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL時,兩溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量銅與一定量的濃硝酸反應,得到硝酸銅溶液和NO2、NO的混合氣體,這些氣體與1.68L O2(標準狀況)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入6molL﹣1NaOH溶液至Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是( )
A.60 mLB.45 mLC.30 mLD.50 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-16 ,H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11, CH3COOH:Ka=1.8×10-5,HClO2:Ka=1.1×10-2,NH3·H2O:Kb=1.8×10-5。
(1)①常溫下,0.1 mol·L-1Na2S溶液和0.1 mol·L-1Na2CO3溶液,堿性更強的是_____,其原因是_______。
②25 ℃時,CH3COONH4溶液顯__性。NaHCO3溶液的pH___CH3COONa溶液的pH。
③NH4HCO3溶液顯__性,原因是_________。
(2)能證明Na2SO3溶液中存在SO32-+H2OHSO3—+OH-水解平衡的事實是___。
A.滴入酚酞溶液變紅,再加H2SO4溶液紅色褪去
B.滴入酚酞溶液變紅,再加BaCl2溶液后產生沉淀且紅色褪去
C.滴入酚酞溶液變紅,再加氯水后紅色褪去
(3)25 ℃時,濃度均為0.1 mol·L-1的NaClO2溶液和CH3COONa溶液,兩溶液中c(ClO2—)___c(CH3COO-)。若要使兩溶液的pH相等應___。
a.向NaClO2溶液中加適量水 b.向NaClO2溶液中加適量NaOH
c.向CH3COONa溶液中加CH3COONa固體 d.向CH3COONa溶液中加適量的水
(4)在空氣中直接加熱CuCl2·2H2O晶體得不到純的無水CuCl2,原因是_______(用化學方程式表示)。由CuCl2·2H2O晶體得到純的無水CuCl2的合理方法是 ________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反應原理如圖所示。關于該反應過程的說法正確的是
溶液,反應原理如圖所示。關于該反應過程的說法正確的是

A.該反應過程中,![]() 是
是![]() 是
是![]() B.當有
B.當有![]() 生成時,轉移
生成時,轉移![]() 電子
電子
C.在![]() 分解過程中,溶液的
分解過程中,溶液的![]() 逐漸降低D.
逐漸降低D.![]() 的氧化性比
的氧化性比![]() 強,還原性比
強,還原性比![]() 弱
弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NOx、COx的消除和再利用對改善生態環境、構建生態文明具有重要的意義。
Ⅰ.反應N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,汽車尾氣中的NO(g)和CO(g)在一定條件下可發生反應2NO(g)+2CO(g)=N2(g)+2CO2(g)△H2。
(1)已知CO的燃燒熱為283.0kJ·mol-1,則△H2=___。
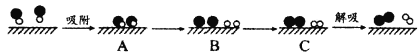
(2)某科研小組嘗試利用固體表面催化工藝進行NO的分解。若用![]() 和
和![]() 分別表示O2、NO、N2和固體催化劑,在固體催化劑表面分解NO的過程如圖所示。從吸附到解吸過程中的能量狀態最低的是__(填字母序號)。
分別表示O2、NO、N2和固體催化劑,在固體催化劑表面分解NO的過程如圖所示。從吸附到解吸過程中的能量狀態最低的是__(填字母序號)。
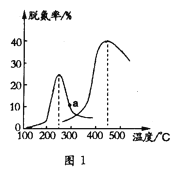
(3)另一研究小組探究催化劑對CO、NO轉化的影響。將NO和CO以一定的流速通過兩種不同的催化劑進行反應,相同時間內脫氮率(即NO的轉化率)隨溫度的變化關系如圖1所示。圖中低于200℃,脫氮率隨溫度升高而變化不大的主要原因是___;a點(填“是”或“不是”)__對應溫度下的平衡脫氮率,理由是__。
Ⅱ.向容積可變的密閉容器中充入1molCO和2.2molH2,在恒溫恒壓條件下發生反應CO(g)+2H2(g)CH3OH(g)△H<0,平衡時CO的轉化率隨溫度、壓強的變化情況如圖2所示。
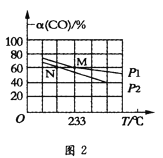
(4)反應速率:N點v正(CO)(填“大于”、“小于”或“等于”)__M點v逆(CO)。
(5)M點時,H2的轉化率為__(計算結果精確到0.1%);用平衡分壓代替平衡濃度計算該反應的平衡常數Kp=__(用含p1的最簡表達式表達,分壓=總壓×物質的量分數)。
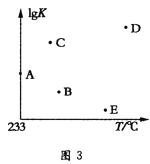
(6)不同溫度下,該反應的平衡常數的對數值(lgK)如圖3所示,則B、C、D、E四點中能正確表示該反應的lgK與溫度(T)的關系的是___(填字母符號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com