
【題目】氮族元素都能形成多種物質,我們可以利用所學物質結構與性質的相關知識取認識和理解。
(1)基態砷原子的價電子排布式為_____;成語“信口雌黃”中的雌黃分子式為As2S3,分子結構如圖 ,則As原子的雜化方式為_________。
,則As原子的雜化方式為_________。
(2)N2與CO的分子結構相似,1個CO分子中含有的∏鍵數目是_____個。
(3)往硫酸銅溶液中通入過量的NH3,可生成可溶性配合物[Cu(NH3)4]SO4·H2O晶體。該晶體所含的非金屬元素中,電負性最大的是_________(填元素符號),第一電離能最大的是_________(填元素符號)。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶體的原因是________。
(4)常溫下PCl5是一種白色晶體,其立方晶系晶體結構模型如左下圖所示,由A、B兩種微粒構成,將其加熱至148℃熔化,形成一種能導電的熔體。已知A微粒與CCl4具有相同空間構型和成鍵形式,則A為_________,B為__________。
(5)磷化硼(BP)是一種超硬耐磨涂層材料,下右圖為其立方晶胞,其中的每個原子均滿足8電子穩定結構,試判斷其熔點_______________(填“高于”或“低于”)金剛石熔點。已知其B-P鍵長均為x cm,則其密度為_______________ g﹒cm-3(列出計算式即可)。

【答案】 4s24p3 sp3雜化 2 O N 乙醇分子極性比水分子極性弱,加入乙醇降低溶劑的極性,從而減小溶質的溶解度 PCl4+ PCl4- 低于 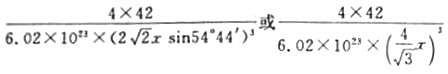
【解析】(1)基態砷原子的電子排布式為[Ar]3d104s24p3,故其價電子排布式為4s24p3,As最外層有5個電子,形成3個共價鍵即δ鍵電子對數為3,另外還有1個孤電子對,所以As的雜化方式為p3雜化;(2)CO的結構可以表示為![]() ,其中橢圓框表示∏鍵,則1個CO分子中含有的∏鍵數目是2個;(3)配合物[Cu(NH3)4]SO4·H2O晶體所含的非金屬元素有N、H、S、O元素,其中非金屬性最強的是O元素,則電負性最大的是O;N元素原子的2p軌道為半滿,其第一電離能最大;乙醇分子極性比水分子極性弱,加入乙醇降低溶劑的極性,從而減小溶質的溶解度,析出[Cu(NH3)4]SO4·H2O晶體;(4)A微粒與CCl4具有相同空間構型則應該原子總數一樣,5個原子且價電子總數相同為32個,故應該帶一個單位正電荷的PCl4+離子,則B為帶負電荷的PCl4-離子;(5)金剛石和磷化硼晶體都是原子晶體,而磷原子的半徑比碳原子大,C—C共價鍵鍵長比B—P小,鍵能大,因此磷化硼晶體的熔點要比金剛石的低; P位于頂點和面心,因此P的個數為8×1/8+6×1/2=4,B位于體心,有4個,晶胞的化學式為BP,因此晶胞的質量為4×42/NAg,B-P的鍵長為x,是體對角線為1/4,即體對角線為4x,因此晶胞的邊長為
,其中橢圓框表示∏鍵,則1個CO分子中含有的∏鍵數目是2個;(3)配合物[Cu(NH3)4]SO4·H2O晶體所含的非金屬元素有N、H、S、O元素,其中非金屬性最強的是O元素,則電負性最大的是O;N元素原子的2p軌道為半滿,其第一電離能最大;乙醇分子極性比水分子極性弱,加入乙醇降低溶劑的極性,從而減小溶質的溶解度,析出[Cu(NH3)4]SO4·H2O晶體;(4)A微粒與CCl4具有相同空間構型則應該原子總數一樣,5個原子且價電子總數相同為32個,故應該帶一個單位正電荷的PCl4+離子,則B為帶負電荷的PCl4-離子;(5)金剛石和磷化硼晶體都是原子晶體,而磷原子的半徑比碳原子大,C—C共價鍵鍵長比B—P小,鍵能大,因此磷化硼晶體的熔點要比金剛石的低; P位于頂點和面心,因此P的個數為8×1/8+6×1/2=4,B位于體心,有4個,晶胞的化學式為BP,因此晶胞的質量為4×42/NAg,B-P的鍵長為x,是體對角線為1/4,即體對角線為4x,因此晶胞的邊長為![]() cm,根據密度的定義,晶胞的密度為
cm,根據密度的定義,晶胞的密度為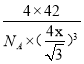 g/cm3。
g/cm3。


科目:高中化學 來源: 題型:
【題目】某化學研究性學習小組為了模擬工業流程從濃縮的海水中提取液溴,查閱資料知:Br2的沸點為59℃,微溶于水,有毒性。設計了如下操作步驟及主要實驗裝置(夾持裝置略去):
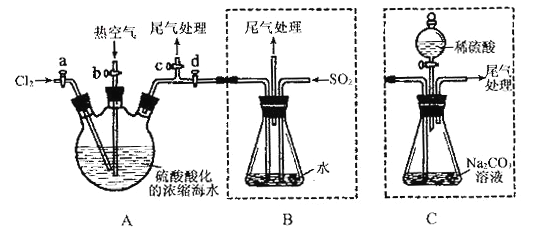
①連接A與B,關閉活塞b、d,打開活塞a、c,向A中緩慢通入至反應結束;②關閉a、c,打開b、d,向A中鼓入足量熱空氣;③進行步驟②的同時,向B中通入足量SO2 ;④關閉b,打開a,再通過A向B中緩慢通入足量Cl2 ;
⑤將B中所得液體進行蒸餾,收集液溴。
請回答:(1)實驗室中采用固液加熱制備氯氣的化學方程式為______________________;
(2)步驟②中鼓入熱空氣的作用為_________________________;
(3)步驟③B中發生的主要反應的離子方程式為_____________________。
(4)此實驗中尾氣可用______________(填選項字母)吸收處理。
a.水 b.濃硫酸 c.NaOH溶液 d.飽和NaCl溶液
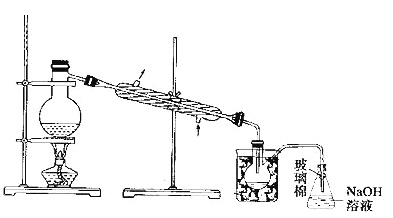
(5)步驟⑤中,用下圖所示裝置進行蒸餾,收集液溴,將裝置圖中缺少的必要儀器補畫出來。
(6)若直接連接A與C,進行步驟①和②,充分反應后,向錐形瓶中滴加稀硫酸,再經步驟⑤,也能制得液溴。滴加稀硫酸之前,C中反應生成了NaBrO3等,請寫出滴加稀硫酸時發生反應的離子方程式_________________。
(7)與B裝置相比,采用C裝置的優點為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯醇(CH2=CH—CH2OH)可發生的化學反應有( )
①加成 ②氧化 ③燃燒 ④加聚 ⑤取代
A. ①②③B. ①②③④
C. ①②③④⑤D. ①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲線如下圖所示(忽略混合時溶液體積的變化)。下列敘述不正確的是

A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 圖中Y點對應的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 圖中Z點對應的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列電離方程式或水解方程式正確的是( )
A.H2S2H++S2﹣
B.NaHSO4═Na++H++SO42﹣
C.CO32﹣+2H2OH2CO3+2OH﹣
D.Al3++3H2OAl(OH)3↓+3H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組氣體中,在通常情況下既能用濃硫酸又能用堿石灰干燥的有( )
A.H2S、O2、N2
B.HCl、Cl2、CO2
C.N2、H2、CO
D.SO2、Cl2、O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 鋁鹽和鐵鹽都可以作凈水劑.
B. 在飽和Na2CO3溶液中通入CO2沒有任何現象
C. 將CO2通入CaCl2溶液中至飽和,有沉淀產生
D. 用澄清石灰水可區別Na2CO3和NaHCO3粉末
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物A是重要的有機化工原料。由A制備有機化合物F的合成路線(部分反應條件略去)如圖所示。
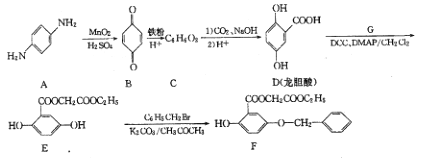
(1)A的水溶液呈_____________(填“酸性”、“堿性”);
(2)C的結構簡式為_____________;
(3)寫出E→F反應的化學方程式_____________;
(4)寫出符合下列條件的龍膽酸乙酯(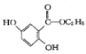 )的一種同分異構體的結構簡式_____________;
)的一種同分異構體的結構簡式_____________;
①能發生銀鏡反應
②不與FeCl3溶液發生顯色反應但其水解產生之一能與FeCl3溶液發生顯色反應
③核磁共振氫譜有四組峰,且峰面積之比為6:2:1:1
(5)參照上述合成路線,設計一條以氯苯、乙醇為原料制備水楊酸乙酯(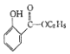 )的合成路線流程圖(無機試劑任用),相關信息:
)的合成路線流程圖(無機試劑任用),相關信息: 。
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com