
【題目】消除含氮化合物對大氣和水體的污染是環境保護的重要研究課題。
(1)化學上采用NH3處理NxOy不僅可以消除污染,還可作為工業生產的能量來源。
已知:![]()
![]()
則用NH3處理NO生成氮氣和氣態水的熱化學方程式為_______________________________。
(2)已知:![]() 。不同溫度下,向三個容器中分別投入相同量的反應物進行反應,測得不同壓強下平衡混合物中
。不同溫度下,向三個容器中分別投入相同量的反應物進行反應,測得不同壓強下平衡混合物中![]() 的物質的量分數如圖所示。
的物質的量分數如圖所示。

①M點的v正___________Q點的v正(填“>”“<”或“=”)。
②圖中M點的平衡常數比N點的平衡常數___________(填“大”“小”或“相等”)
(3)水體中過量氨氣(以![]() 表示)會導致水體富營養化。
表示)會導致水體富營養化。

①用次氯酸鈉除去氨氮的原理如圖所示。寫出總反應化學方程式____________。
②該反應需控制溫度,溫度過高時氨氮去除率降低的原因是_____________________。
(4)氮氧化物也可用堿溶液吸收。若NO和![]() 混合氣體被NaOH溶液完全吸收,只生成一種鹽,則該鹽的化學式為___________;已知常溫下,
混合氣體被NaOH溶液完全吸收,只生成一種鹽,則該鹽的化學式為___________;已知常溫下,![]() ,則反應
,則反應![]() 的平衡常數的數值為_____________。
的平衡常數的數值為_____________。
(5)利用反應![]() (未配平)消除用電器
(未配平)消除用電器![]() 的簡易裝置如圖所示。
的簡易裝置如圖所示。

①a電極上的反應式為____________________________________________。
②常溫下,若用該電池電解0.6L飽和食鹽水,一段時間后,測得飽和食鹽水pH變為13,則理論上b電極上消耗B氣體的體積為___________ mL(標準狀況;假設電解過程中溶液體積不變)。
【答案】4NH3(g)+6NO(g)═5N2(g)+6H2O(g) △H=-1784.4kJmol-1 > 大 2NH3+3NaClO═N2+3NaCl+3H2O 溫度過高,加快了中間產物HClO的分解,導致氨氮去除率降低 NaNO2 5×1010 2NH3-6e-+6OH-=2N2+6H2O 336
【解析】
(1)根據蓋斯定律分析解答;
(2)①M點比Q點壓強大;
②M點氨氣的物質的量分數比N點大,結合放熱反應分析判斷;
(3)①根據原理圖,NH3、NaClO是反應物,次氯酸、鹽酸、氫氧化鈉為中間產物,氯化鈉、氮氣和水是生成物,據此書寫反應的化學方程式;②根據溫度對中間產物HClO的影響分析解答;
(4)NO和NO2混合氣體被NaOH溶液完全吸收,只生成一種鹽,反應中只有N元素化合價發生變化,NO中N元素化合價為+2、NO2中N元素化合價為+4,則生成的鹽中N元素化合價為+3價;根據HNO2(aq)+NaOH(aq)NaNO2(ag)+H2O(1)的平衡常數表達式結合水的離子積常數分析計算;
(5)①根據圖中電子的運動方向可知,a極為負極,為氨氣在堿性條件下發生氧化反應生成氮氣的反應;②根據2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑~2e-,一段時間后,測得飽和食鹽水pH變為13,則溶液中n(OH-)=0.6L×0.1mol/L=0.06mol,b極電極反應式為:2NO2+8e-=N2+8OH-,結合電子守恒分析計算。
2NaOH+H2↑+Cl2↑~2e-,一段時間后,測得飽和食鹽水pH變為13,則溶液中n(OH-)=0.6L×0.1mol/L=0.06mol,b極電極反應式為:2NO2+8e-=N2+8OH-,結合電子守恒分析計算。
(1)①2NO(g)=N2(g)+O2(g) △H=-177kJ/mol,②4NH3(g)+3O2(g)═2N2(g)+6H2O(g) △H=-1253.4kJ/mol,根據蓋斯定律,將②+①×3得:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) △H=(-1253.4kJ/mol)+(-177kJ/mol)×3=-1784.4kJmol-1;故答案為:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) △H=-1784.4kJmol-1;
(2)①M點比Q點壓強大,壓強增大,反應速率加快,則M點的v正>Q點的v正,故答案為:>;
②M點氨氣的物質的量分數比N點大,該反應是放熱反應,則M點的溫度高,升高溫度平衡正向移動,平衡常數增大,則M點的平衡常數比N點的平衡常數大,故答案為:大;
(3)①根據次氯酸鈉除去氨氮的原理圖可知,NH3、NaClO是反應物,次氯酸、鹽酸、氫氧化鈉為中間產物,氯化鈉、氮氣和水是生成物,所以反應的化學方程式為:2NH3+3NaClO═N2+3NaCl+3H2O,故答案為:2NH3+3NaClO═N2+3NaCl+3H2O;
②溫度過高時,加快了中間產物HClO的分解,導致氨氮去除率降低,故答案為:溫度過高時,加快了中間產物HClO的分解,導致氨氮去除率降低;
(4)NO和NO2混合氣體被NaOH溶液完全吸收,只生成一種鹽,反應中只有N元素化合價發生變化,NO中N元素化合價為+2、NO2中N元素化合價為+4,則生成的鹽中N元素化合價為+3價,為亞硝酸鹽,因此化學式為NaNO2;反應HNO2(aq)+NaOH(aq) NaNO2(ag)+H2O(1)的平衡常數K=![]() =
=![]() =
=![]() =
=![]() =5×1010,故答案為:NaNO2;5×1010;
=5×1010,故答案為:NaNO2;5×1010;
(5)①根據圖中電子的運動方向可知,a極失去電子發生氧化反應,則為氨氣在堿性條件下發生氧化反應生成氮氣的反應,電極反應式為:2NH3-6e-+6OH-=2N2+6H2O,故答案為:2NH3-6e-+6OH-=2N2+6H2O;
②電解0.6L飽和食鹽水,電解反應為:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑~2e-,一段時間后,測得飽和食鹽水pH變為13,則溶液中n(OH-)=0.6L×0.1mol/L=0.06mol,轉移電子為0.06mol,同一串聯電路轉移電子數目相同,設B極消耗的NO2
2NaOH+H2↑+Cl2↑~2e-,一段時間后,測得飽和食鹽水pH變為13,則溶液中n(OH-)=0.6L×0.1mol/L=0.06mol,轉移電子為0.06mol,同一串聯電路轉移電子數目相同,設B極消耗的NO2
2NO2 + 8e- = N2+8OH-
44.8L 8mol
V0.06mol
則V=![]() =0.336L=336mL,故答案為:336。
=0.336L=336mL,故答案為:336。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】用10mL的0.1mol·L-1BaCl2溶液恰好可使相同體積的硫酸鐵、硫酸鋅和硫酸鉀三種溶液中的硫酸根離子完全轉化為硫酸鋇沉淀,則三種硫酸鹽溶液的物質的量濃度之比是
A.3∶1∶1B.3∶2∶2C.1∶2∶3D.1∶3∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G均為短周期主族元素,其原子序數依次增大。其中B的單質在常溫下為雙原子分子,它與A的單質可形成化合物X,X的水溶液呈堿性;A、D同主族,C的原子序數等于A、B原子序數之和;E是地殼中含量最高的金屬元素,F元素的原子最外層比次外層少兩個電子。用化學用語回答下列問題:
(1)G在元素周期表中的位置為_______________________;
(2)元素C、D、E的簡單離子的半徑由大到小關系為_______________________;
(3)A分別與C、F形成的氫化物沸點較高的是_________,原因_______________________;
(4)用電子式表示化合物D2C的形成過程________________________________________;
C、D還可形成化合物D2C2,D2C2含有的化學鍵是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以水為溶劑進行中和滴定的原理是:H3O++OH-=2H2O.已知液態SO2和純水的導電性相近,因為液態SO2也會發生自離解:SO2(l)+SO2(l)![]() SO32-+SO2+.若以液態SO2為溶劑,用SOCl2滴定Cs2SO3,則以下敘述錯誤的是 ( )
SO32-+SO2+.若以液態SO2為溶劑,用SOCl2滴定Cs2SO3,則以下敘述錯誤的是 ( )
A. 該滴定反應可以表示為:SO32-+ SO2+=2SO2
B. 在一定溫度下,液態SO2中c(SO32-)與c(SO2+)的乘積是一個常數
C. 自離解的存在,說明SO2是離子化合物
D. 可通過導電能力變化來判斷是否到達滴定終點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.電解精煉銅時,若轉移2NA個電子,則陽極減少的質量為64g
B.合成氨生產中將NH3液化分離,可加快正反應速率,提高H2的轉化率
C.![]() 在常溫下能自發進行,則該反應的△H>0
在常溫下能自發進行,則該反應的△H>0
D.常溫下,![]() 。欲使溶液中
。欲使溶液中![]() ,需調節溶液的
,需調節溶液的![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工農業生產、生活中有著重要作用。
(1)在T℃時,將0.6molH2和0.4molN2置于容積為2 L的密閉容器中(壓強為mPa)發生反應:3H2+N2![]() 2NH3△H<0。若保持溫度不變,某興趣小組同學測得反應過程中容器內壓強隨時間變化如圖所示:8 min內分鐘NH3的平均生成速率為___mol·L-1·min-1。
2NH3△H<0。若保持溫度不變,某興趣小組同學測得反應過程中容器內壓強隨時間變化如圖所示:8 min內分鐘NH3的平均生成速率為___mol·L-1·min-1。

(2)仍在T℃時,將0.6molH2和0.4molN2置于一容積可變的密閉容 器中。
①下列各項能說明該反應已達到平衡狀態的是______(填序號)。
a.容器內N2、H2、NH3的濃度之比為l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合氣體的密度保持不變
e.容器中氣體的平均相對分子質量不隨時間而變化
②該條件下達到平衡時NH3的體積分數與題(1)條件下NH3的體積分數相比________(填“變大”“變小”或“不變”)。
③達到平衡后,改變某一條件使反應速率發生了如圖所示的變化,改 變的條件可能是_________。

a.升高溫度,同時加壓
b.降低溫度,同時減壓
c.保持溫度、壓強不變,增大反應物濃度
d.保持溫度、壓強不變,減小生成物濃度
(3)硝酸廠的尾氣含有氮氧化物,不經處理直接排放將污染空氣。 氨氣能將氮氧化物還原為氮氣和水,其反應機理為:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)![]() H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)![]() H=-bkJ·mol-1
H=-bkJ·mol-1
則NH3直接將NO2還原為N2的熱化學方程式為:______________。
若標準狀況下NO與NO2混合氣體40.32L被足量氨水完全吸收,產生標準狀況下氮氣42.56L。該混合氣體中NO與NO2的體積之比為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在一固定體積的密閉容器中,能說明可逆反應A (g)+3B (g)![]() 2C (g)達到平衡的說法中,正確的組合是
2C (g)達到平衡的說法中,正確的組合是
①C 的生成速率和 C 的分解速率相等
②單位時間內生成 a mol A,同時生成 3a mol B
③氣體密度不再變化
④ 混合氣體的平均相對分子質量不變
⑤A、B、C 的物質的量之比為 1∶3∶2
A.①④B.②③⑤C.①④⑤D.④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚酯增塑劑G及某醫藥中間體H的一種合成路線如圖(部分反應條件略去):
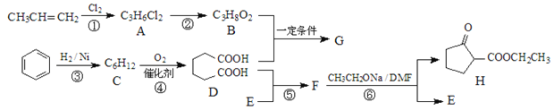
已知: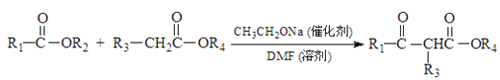 +R2OH
+R2OH
(1)A的名稱是___________________。
(2)寫出下列反應的反應類型:反應①是_____________,反應④是__________。
(3)G的結構簡式為_____________________,F的分子式為_____________________。
(4)寫出反應②的化學方程式____________________。
(5)C存在多種同分異構體,寫出核磁共振氫譜只有兩種峰的同分異構體的結構簡式:
____________。
(6)僅用一種試劑就可以鑒別B、D、H,該試劑是____________。
(7)利用以上合成路線的信息,以甲苯、乙醇、乙醇鈉為原料合成下面有機物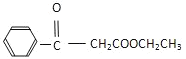 (無機試劑任選)___________。
(無機試劑任選)___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】放熱反應CO(g)+H2O(g)![]() CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。其他條件不變,升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則
CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。其他條件不變,升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則
A.若增大CO的濃度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com