
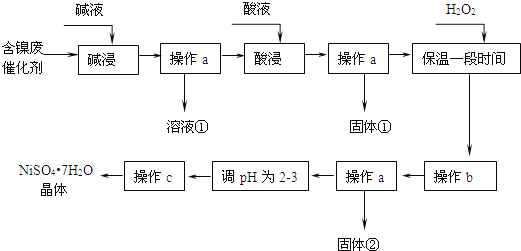
【題目】鎳是有機合成的重要催化劑.某化工廠有含鎳催化劑廢品![]() 主要成分是鎳,雜質是鐵、鋁單質及其化合物,少量難溶性雜質
主要成分是鎳,雜質是鐵、鋁單質及其化合物,少量難溶性雜質![]() 某學習小組設計如下流程利用含鎳催化劑廢品制備硫酸鎳晶體:
某學習小組設計如下流程利用含鎳催化劑廢品制備硫酸鎳晶體:
幾種難溶堿開始沉淀和完全沉淀的pH:
沉淀物 | 開始沉淀 | 完全沉淀 |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列問題:
![]() 溶液
溶液![]() 中含金屬元素的離子是 ______ .
中含金屬元素的離子是 ______ .
![]() 用離子方程式表示加入雙氧水的目的 ______
用離子方程式表示加入雙氧水的目的 ______ ![]() 雙氧水可以用下列物質替代的是 ______ .
雙氧水可以用下列物質替代的是 ______ .
A.氧氣![]() 漂液
漂液![]() 氯氣
氯氣![]() 硝酸
硝酸
![]() 操作b調節溶液范圍為
操作b調節溶液范圍為![]() ,其目的是 ______ .
,其目的是 ______ .
![]() 操作a和c需要共同的玻璃儀器是 ______
操作a和c需要共同的玻璃儀器是 ______ ![]() 上述流程中,防止濃縮結晶過程中
上述流程中,防止濃縮結晶過程中![]() 水解的措施是 ______ .
水解的措施是 ______ .
![]() 如果加入雙氧水量不足或“保溫時間較短”,對實驗結果的影響是 ______
如果加入雙氧水量不足或“保溫時間較短”,對實驗結果的影響是 ______ ![]() 設計實驗證明產品中是否含“雜質”
設計實驗證明產品中是否含“雜質”![]() 不考慮硫酸鎳影響
不考慮硫酸鎳影響![]() : ______ .
: ______ .
【答案】![]()
![]() A 除去
A 除去![]() 玻璃棒 調節溶液pH為
玻璃棒 調節溶液pH為![]() 產品中混有綠礬 取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有
產品中混有綠礬 取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有![]()
【解析】
(1)根據廢料成分知,堿和鋁、氧化鋁反應,溶液中含有偏鋁酸根離子;
(2)根據數據表知,應將亞鐵離子轉化成鐵離子除去,加入雙氧水氧化亞鐵離子生成鐵離子,不引入新雜質.用漂白液(主要成分次氯酸鈉)、氯氣、硝酸替代雙氧水會引入新雜質.用氧氣替代雙氧水;
(3)調節溶液pH使Fe3+完全沉淀,使Ni2+不沉淀;
(4)過濾、蒸發都需要用玻璃儀器:玻璃棒,氫氧化鎳難溶于水,在結晶過程中,硫酸鎳可能水解,保持溶液較強酸性,抑制鎳離子水解;
(5)如果加入雙氧水不足,或反應時間較短,亞鐵離子不能完全轉化成鐵離子,產品中會混有硫酸亞鐵晶體,檢驗Fe2+試劑可以是氯水,KSCN溶液、酸性高錳酸鉀溶液等。
![]() 堿和鋁、氧化鋁均能反應,溶液中含有的含有金屬的離子是偏鋁酸根離子;
堿和鋁、氧化鋁均能反應,溶液中含有的含有金屬的離子是偏鋁酸根離子;
![]() 亞鐵離子具有還原性,雙氧水具有氧化性,加入雙氧水是為了氧化亞鐵離子成為鐵離子,離子反應方程式為:
亞鐵離子具有還原性,雙氧水具有氧化性,加入雙氧水是為了氧化亞鐵離子成為鐵離子,離子反應方程式為:![]() ,漂白液
,漂白液![]() 主要成分次氯酸鈉
主要成分次氯酸鈉![]() 、氯氣、硝酸替代雙氧水會引入新雜質,則此替代試劑為氧氣,故答案為 A;
、氯氣、硝酸替代雙氧水會引入新雜質,則此替代試劑為氧氣,故答案為 A;
![]() 由表格可知,氫氧化鐵的沉淀范圍為,
由表格可知,氫氧化鐵的沉淀范圍為,![]() ,鎳離子的沉淀范圍是
,鎳離子的沉淀范圍是![]() ,調節pH在
,調節pH在![]() 的目的是除去鐵離子,但是不沉淀鎳離子;
的目的是除去鐵離子,但是不沉淀鎳離子;
![]() 操作a是過濾得到固體和濾液,c是蒸發濃縮得到晶體過濾得到
操作a是過濾得到固體和濾液,c是蒸發濃縮得到晶體過濾得到![]() ,操作a、c中均需使用的儀器為玻璃棒,鎳離子水解呈酸性,溶液始終保持溶液呈酸性可以抑制其水解;
,操作a、c中均需使用的儀器為玻璃棒,鎳離子水解呈酸性,溶液始終保持溶液呈酸性可以抑制其水解;
![]() 如果加入雙氧水不足,或反應時間較短,亞鐵離子不能完全被氧化成鐵離子,產品中混有綠礬;亞鐵離子可以被氧化為鐵離子,加入氧化劑即可驗證,正確的方法是:取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有亞鐵離子。
如果加入雙氧水不足,或反應時間較短,亞鐵離子不能完全被氧化成鐵離子,產品中混有綠礬;亞鐵離子可以被氧化為鐵離子,加入氧化劑即可驗證,正確的方法是:取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有亞鐵離子。


科目:高中化學 來源: 題型:
【題目】![]() 和
和![]() 都是鋰離子電池的電極材料,可利用鈦鐵礦
都是鋰離子電池的電極材料,可利用鈦鐵礦![]() 主要成分為
主要成分為![]() ,還含有少量MgO、
,還含有少量MgO、![]() 等雜質
等雜質![]() 來制備,工藝流程如下:
來制備,工藝流程如下:
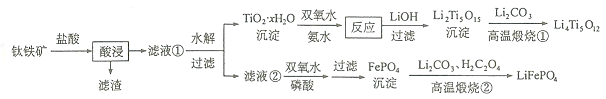
回答下列問題:
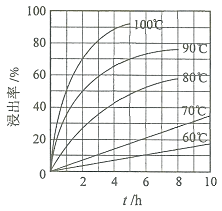
![]() “酸浸”實驗中,鐵的浸出率結果如下圖所示。由圖可知,當鐵的浸出率為
“酸浸”實驗中,鐵的浸出率結果如下圖所示。由圖可知,當鐵的浸出率為![]() 時,所采用的實驗條件為______。
時,所采用的實驗條件為______。
![]() “酸浸”后,鈦主要以
“酸浸”后,鈦主要以![]() 形式存在,寫出相應反應的離子方程式______。
形式存在,寫出相應反應的離子方程式______。
![]() 沉淀與雙氧水、氨水反應40min所得實驗結果如下表所示:
沉淀與雙氧水、氨水反應40min所得實驗結果如下表所示:
溫度 | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | span>88 |
分析![]() 時
時![]() 轉化率最高的原因______。
轉化率最高的原因______。
![]() 中Ti的化合價為
中Ti的化合價為![]() ,其中過氧鍵的數目為______。
,其中過氧鍵的數目為______。
![]() 若“濾液
若“濾液![]() ”中
”中![]() ,加入雙氧水和磷酸
,加入雙氧水和磷酸![]() 設溶液體積增加1倍
設溶液體積增加1倍![]() ,使
,使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此時是否有
,此時是否有![]() 沉淀生成?______
沉淀生成?______![]() 列式計算
列式計算![]() 。
。![]() 、
、![]() 的
的![]() 分別為
分別為![]() 、
、![]()
![]() 寫出“高溫煅燒
寫出“高溫煅燒![]() ”中由
”中由![]() 制備
制備![]() 的化學方程式______。
的化學方程式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備 1,2二溴乙烷的反應原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
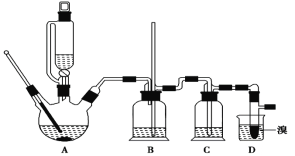
可能存在的主要副反應有:乙醇在濃硫酸的存在下在140℃脫水生成乙醚。用少量溴和足量的乙醇 制備1,2-二溴乙烷的裝置如下圖所示:
有關數據列表如下:
乙醇 | 1 ,2-二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/g·cm-3 | 0 .79 | 2.2 | 0 .71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -130 | 9 | -116 |
回答下列問題:
(1)在此制備實驗中,要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是_________。(填正確選項前的字母)
a.引發反應 b.加快反應速度
c.防止乙醇揮發 d.減少副產物乙醚生成
(2)在裝置 C 中應加入________,其目的是吸收反應中可能生成的酸性氣體。(填正確選項前的字母)
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(3)判斷 1,2-二溴乙烷制備反應已經結束的最簡單方法是_________________________。
(4)將 1,2 二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在__________________層(填“上”、“下”)。
(5)若產物中有少量未反應的 Br2,最好用___________洗滌除去。(填正確選項前的字母)
a.水 b.氫氧化鈉溶液 c.碘化鈉溶液 d.乙醇
(6)若產物中有少量副產物乙醚,可用_____的方法除去。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1molCO和1molNO2充入密閉容器中,在催化劑存在下發生反應NO2(g)+CO(g)![]() CO2(g)+NO(g)并達到化學平衡,發現有50%的CO轉化為CO2。在其它條件不變的情況下,若將1molCO和2molNO2充入上述反應器中,則反應達到化學平衡時,混合氣體中CO2的體積分數是( )
CO2(g)+NO(g)并達到化學平衡,發現有50%的CO轉化為CO2。在其它條件不變的情況下,若將1molCO和2molNO2充入上述反應器中,則反應達到化學平衡時,混合氣體中CO2的體積分數是( )
A.1/9B.1/6C.2/9D.1/3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知海水中的溴含量約為65 mg/L,從海水中提取溴的工業流程如下:
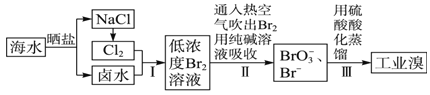
(1)上述步驟Ⅰ中已獲得游離態的溴,步驟Ⅱ又將其轉化成化合態的溴,目的是_____________。
(2)步驟Ⅱ通入熱空氣吹出Br2,利用了溴的____________(填序號)。
A.氧化性 B.還原性 C.揮發性 D.腐蝕性
(3)步驟Ⅱ中涉及的離子反應如下,請在方框內填入正確的化學計量數:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電石漿是氯堿工業中的一種廢棄物,其大致組成如表所示:
成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶性的物質 |
質量分數/% | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
用電石漿可生產無水CaCl2,某化工廠設計了以下工藝流程:
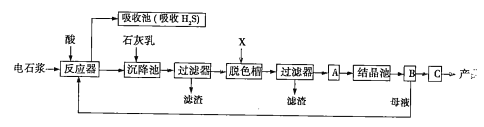
已知氯化鈣晶體的化學式是CaCl2·6H2O;H2S是一種酸性氣體,且具有還原性。
(1)反應器中加入的酸應選用______________。
(2)脫色槽中應加入的物質X是__________;設備A的作用是__________;設備B的名稱為__________;設備C的作用是_______________。
(3)為了滿足環保要求,需將廢氣H2S通入吸收池,下列物質中最適合作為吸收劑的是_______(填序號)。反應的化學方程式為____________________________。
A.水 B.濃硫酸 C.石灰乳 D.硝酸
(4)將設備B中產生的母液重新引入反應器的目的是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鍶(SrSO4)在水中的沉淀溶解平衡曲線如下圖,

下列說法正確的是( )
A. 313K時,根據曲線計算可知Ksp(SrSO4) 數量級為10-5
B. 三個不同溫度中,313 K時Ksp(SrSO4)最大
C. 283 K時,圖中a點對應的溶液是飽和溶液
D. 283 K下的SrSO4飽和溶液升溫到363 K后變為不飽和溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】福酚美克是一種影響機體免疫功能的藥物,可通過以下方法合成:
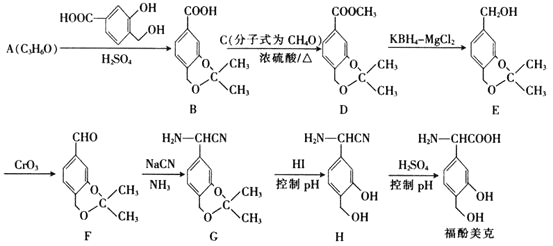
已知:
①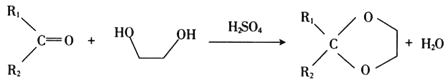 ;
;
②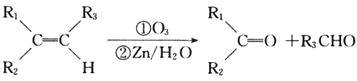 。
。
(1)C的名稱為________,A的結構簡式為________________。
(2)福酚美克中所含官能團有________________![]() 填名稱
填名稱![]() 。
。![]() 的反應類型為________。
的反應類型為________。
(3)已知![]() 的轉化屬于取代反應,則該反應的另一產物的結構簡式為________。
的轉化屬于取代反應,則該反應的另一產物的結構簡式為________。
(4)寫出F發生銀鏡反應的化學方程式:________________________________。
(5)E的一種同分異構體Q滿足下列條件,則Q的結構簡式為________。
①Q的苯環上只有2個取代基,且Q的核磁共振氫譜圖中有4組吸收峰
②Q能與![]() 溶液發生顯色反應
溶液發生顯色反應
③![]() 最多能與
最多能與![]() 發生反應
發生反應
(6)根據已有知識并結合題給信息,寫出以![]() 為原料
為原料![]() 無機試劑任用
無機試劑任用![]() 制備
制備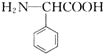 的合成路線流程圖_________
的合成路線流程圖_________![]() 無機試劑任選
無機試劑任選![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com