
【題目】甲醇脫氫可制取甲醛:CH3OH(g)HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如圖所示(已知反應在1L的密閉容器中進行、甲醇的物質的量為1mol).下列有關說法中正確的是( ) 
A.脫氫反應的△H<0
B.600 K時,Y點甲醇的v(逆)<v(正)
C.從Y點到Z點可通過增大壓強
D.在t1K時,該反應的平衡常數為8.1
【答案】D
【解析】解:A.由圖可知,溫度越高甲醇平衡轉化率越大,說明升高溫度化學平衡正向移動,因此甲醇脫氫反應為吸熱反應即△H>0,故A錯誤;
B.600K時Y點甲醇轉化率大于X點甲醇平衡轉化率,說明反應逆向進行即:υ(正)<υ(逆),故B錯誤;
C.由圖可知Y點和Z點甲醇轉化率相等,若增大壓強,平衡向逆反應方向移動,甲醇轉化率減小,則甲醇的轉化率將小于Z點甲醇轉化率,故C錯誤;
D.甲醇初始濃度為1mol/L,在t1K時甲醇的轉化率為0.9,則平衡時甲醇消耗的濃度為:1mol/L×0.9=0.9mol/L,平衡時甲醇濃度為0.1mol/L,根據反應CH3OH(g)HCHO(g)+H2(g)可知平衡時甲醛和氫氣濃度相等,都是0.9mol/L,則在t1K時該反應的平衡常數K= ![]() =8.1,故D正確;
=8.1,故D正確;
故選D.
【考點精析】解答此題的關鍵在于理解反應熱和焓變的相關知識,掌握在化學反應中放出或吸收的熱量,通常叫反應熱,以及對化學平衡狀態本質及特征的理解,了解化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效).


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的數值,下列說法正確的是( )
A.9.8g由H2SO4和H3PO4組成的混合物中含有的氧原子數為0.4NA
B.1mol Na218O2中所含的中子數為42NA
C.28g鐵粉與足量稀硝酸反應,轉移的電子數為NA
D.1mol環己烷中含有的共價鍵數為12NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一小塊鈉投入到CuSO4溶液中,一定觀察不到的現象是( )
A. 鈉浮在溶液表面
B. 發出“嘶嘶”的響聲,鈉塊四處游動,逐漸變小直至消失
C. 有藍色沉淀生成
D. 有紅色粉末生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量純凈的氨基甲酸銨置于密閉真空恒容容器中(固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判斷該分解反應已經達到化學平衡的是( )
A.密閉容器中混合氣體的密度不變
B.密閉容器中c(NH3):c(CO2)=2:1
C.2v(NH3)=v(CO2)
D.密閉容器中氨氣的體積分數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知HF 酸性強于CH3COOH,常溫下有下列三種溶液.有關敘述不正確的是( )
編號 | ① | ② | ③ |
PH | 11 | 3 | 3 |
溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
A.CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO﹣)/c(Na+)增大
B.①、②等體積很合后:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.向②加入NaF固體,CH3COOH電離平衡正向移動
D.中和相同體積的②、③,需消耗①的體積②<③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在甲、乙、丙、丁四個燒杯里分別放入0.1mol的鈉,氧化鈉,過氧化鈉和氫氧化鈉,然后各加入100mL水,使固體完全溶解,則甲、乙、丙、丁的溶液中溶質的質量分數大小的順序為
A.甲>乙>丙>丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】淀粉通過下列轉化可以得到C(以下反應部分條件略去): 淀粉 ![]() M
M ![]() N→A
N→A ![]() D
D ![]() C
C
A~F六種物質可以發生如圖轉化:
注:[O]表示足最常用氧化劑;C 常用于汽車的防凍液.
(1)A的官能團的結構簡式為 , 其產量可以用來衡量一個國家石油化工的發展水平.N 生成A的反應條件為 , B的一種同分異構體的名稱為 .
(2)①寫出E生成F的離子方程式 . ②寫出C2H2O2生成E的化學方程式([O]為含銅物質) .
(3)C與E一定條件下反應的生成物中相對分子質量最小的物質的摩爾質量為 .
(4)H分子含有4個碳,且為C2H2O2的同系物,H的同分異構體中含有 ![]() ,且無環狀結構的同分異構體有種.(不考慮立體異構)
,且無環狀結構的同分異構體有種.(不考慮立體異構)
(5)芳香化合物G僅含碳、氫、氧三種元素,相對分子質量為110.G能與碳酸鈉反應,不能與碳酸氫鈉反應,且G分子中烴基上的一氯取代物只有一種.則G的結構簡式為 .
(6)已知: ![]() . 以乙烯為起始原料,選用必要的無機試劑合成正丁酸,寫出合成路線(用結構簡式表示有機物),用箭頭表示轉化關系,箭頭上注明試劑和反應條件).
. 以乙烯為起始原料,選用必要的無機試劑合成正丁酸,寫出合成路線(用結構簡式表示有機物),用箭頭表示轉化關系,箭頭上注明試劑和反應條件).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠礬是含有一定量結晶水的硫酸亞鐵,在工農業生產中具有重要的用途。某化學興趣小組對綠礬的一些性質進行探究。回答下列問題:
(1)在試管中加入少量綠礬樣品,加水溶解,滴加少量稀硫酸將溶液酸化,滴加KSCN溶液,溶液顏色無明顯變化。再向試管中通入空氣,溶液逐漸變紅。寫出該過程的所有離子反應方程式:___________________________。
(2)為測定綠礬中結晶水含量,將石英玻璃管(帶兩端開關K1和K2)(設為裝置A)稱重,記為m1 g。將樣品裝入石英玻璃管中,再次將裝置A稱重,記為 m2 g。按下圖連接好裝置進行實驗。
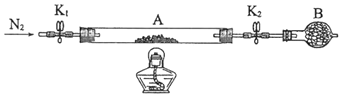
①儀器B的名稱是______________。
②將下列實驗操作步驟正確排序_______(填標號);重復上述操作步驟,直至A恒重,記為m3 g。
A.點燃酒精燈,加熱
B.熄滅酒精燈
C.關閉K1和K2
D.打開K1和K2,緩緩通入N2
e.稱量A
f.冷卻至室溫
③根據實驗記錄,計算綠礬化學式中結晶水數目x=_______________。(列式表示).若實驗時按a、d次序操作,則使x__________(填“偏大”“偏小”或“無影響”)。
(3)測定硫酸亞鐵的分解產物發現:一種產物為紅棕色固體,另外兩種產物為氣體,反應產物中氧化產物與還原產物的物質的量相等,寫出該過程的化學方程式:________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com