
【題目】![]() 用于石油工業脫硫與脫色,是一種不溶于水和乙醇的白色粉末,在潮濕空氣中可被迅速氧化。實驗室用
用于石油工業脫硫與脫色,是一種不溶于水和乙醇的白色粉末,在潮濕空氣中可被迅速氧化。實驗室用![]() 混合溶液與
混合溶液與![]() 溶液反應制取
溶液反應制取![]() ,相關裝置如圖。回答以下問題:
,相關裝置如圖。回答以下問題:
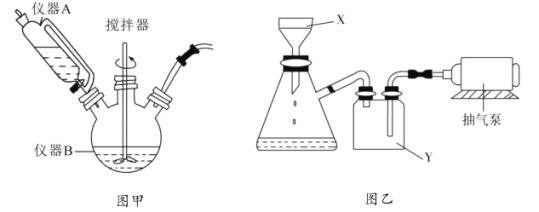
(1)圖甲中儀器B的名稱是__________,制備過程中![]() 過量會發生副反應生成
過量會發生副反應生成![]() ,為提高產率,儀器A中所加試劑應為__________________;
,為提高產率,儀器A中所加試劑應為__________________;
(2)丙圖是體系pH隨時間變化關系圖,制取![]() 反應的離子方程式為____________,丁圖是產率隨pH變化關系圖,實驗過程中往往用
反應的離子方程式為____________,丁圖是產率隨pH變化關系圖,實驗過程中往往用![]() 混合溶液代替單一
混合溶液代替單一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
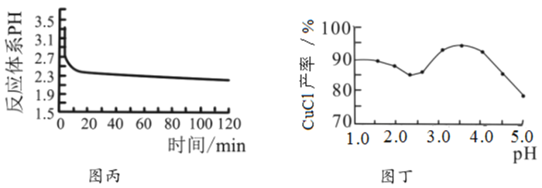
(3)反應完成后經抽濾、洗滌、干燥獲得產品。抽濾裝置如圖乙所示,抽濾所用的儀器包括布氏漏斗、吸濾瓶、安全瓶和抽氣泵。其中抽氣泵的作用是使吸濾瓶與安全瓶中的____________________,跟常規過濾相比,采用抽濾的優點是____________(寫一條);洗滌時,用“去氧水”作洗滌劑洗滌產品,作用是__________________。
(4)![]() 不穩定易分解為
不穩定易分解為![]() ,
,![]() 時
時![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固體和
固體和![]() 溶液混合,加熱,得到紅色沉淀,該沉淀的化學式為___________。
溶液混合,加熱,得到紅色沉淀,該沉淀的化學式為___________。
【答案】三頸燒瓶 ![]() 溶液
溶液 ![]() 利用
利用![]() 的堿性及時除去系統中反應生成的
的堿性及時除去系統中反應生成的![]() 壓強減小 可加快過濾速度、得到較干燥的沉淀 洗去晶體表面的雜質離子,同時防止
壓強減小 可加快過濾速度、得到較干燥的沉淀 洗去晶體表面的雜質離子,同時防止![]() 被氧化
被氧化 ![]()
【解析】
在圖甲的裝置的三頸燒瓶中CuSO4—NaCl混合溶液中加入Na2SO3溶液,反應生成CuCl沉淀,反應過程中溶液中H+的濃度增大,根據丁圖是CuCl的產率隨pH變化關系圖可知,pH在3.5左右,CuCl的產率比較高,為了得到更多的CuCl,實驗過程中用Na2SO3—Na2CO3溶液代替Na2SO3溶液來調控溶液的pH,CuCl在潮濕空氣中很容易被氧化,所以用去氧水而不用普通的純凈水洗滌CuCl產品,主要是防止CuCl被氧化。
(1)圖甲中儀器B為三頸燒瓶;制備過程中Na2SO3過量會發生副反應生成[Cu(SO3)2]3-,為提高產率,可控制Na2SO3的加入量,儀器A中所加試劑應為Na2SO3溶液;
(2)CuSO4—NaCl混合溶液中加入Na2SO3溶液,反應生成CuCl沉淀,同時溶液的酸性增強,生成硫酸,反應的離子方程式為:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;結合圖丁可知,pH在3.5左右,CuCl的產率比較高,故用Na2SO3—Na2CO3溶液代替Na2SO3溶液,可與生成的H+反應,及時除去系統中反應生成的H+,有利于CuCl的生成;
(3)抽濾又稱減壓過濾,真空過濾,利用抽氣泵使抽濾瓶中的壓強降低,達到固液分離的目的方法,故抽氣泵的作用是使吸濾瓶與安全瓶中的壓強減小;跟常規過濾相比,采用抽濾的優點是:①過濾速度快、②得到的固體比較干燥;CuCl在潮濕空氣中可被迅速氧化,所以用“去氧水”作洗滌劑洗滌產品,作用是洗去晶體表面的雜質離子,同時防止CuCl被氧化;
(4)由題意可知,氫氧化亞銅的溶度積小于氯化亞銅的溶度積,對應化學式中陰陽離子個數比相同的物質,溶度積越大,該物質的溶解度就越大,溶度積大的物質會向溶度積小的物質轉化,所以把氯化亞銅和氫氧化鈉溶液混合,二者反應生成氫氧化亞銅,反應方程式為CuCl(s)+OH-(aq)![]() Cl-(aq)+CuOH(s),CuOH受熱分解生成磚紅色的Cu2O,2CuOH
Cl-(aq)+CuOH(s),CuOH受熱分解生成磚紅色的Cu2O,2CuOH![]() Cu2O+H2O。
Cu2O+H2O。


科目:高中化學 來源: 題型:
【題目】甲、乙兩燒杯中各盛放有100mL2mol/L的鹽酸和NaOH溶液,向兩燒杯中分別加入等質量的鋁粉,充分反應結束后測得生成的氣體體積比為甲:乙=3:4,則加入鋁粉的質量為( )
A.4.8gB.3.2gC.2.4gD.1.6g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上,在一定條件下利用乙烯和水蒸氣反應制備乙醇。反應原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知幾種共價鍵的鍵能如下:
化學鍵 | C-H | C=C | H-O | C-C | C-O |
鍵能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列說法錯誤的是
A. 上述合成乙醇的反應原子利用率為100%
B. 相同時間段內,用該反應中三種物質表示的該反應的化學反應速率相等
C. 碳碳雙鍵的鍵能大于碳碳單鍵鍵能,但碳碳單鍵更穩定
D. 上述反應式中,△H=+34kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在原子序數為1~18的元素中(用化學式填寫):
(1)與水反應最劇烈的金屬單質是________。
(2)與水反應最劇烈的非金屬單質是________。
(3)在室溫下有顏色的氣體單質是______和__________。
(4)在空氣中容易自燃的單質是________。
(5)除稀有氣體元素外,原子半徑最大的元素是_________,它的原子結構示意圖是_______。
(6)原子半徑最小的元素是______,其次是_____________________。
(7)氣態氫化物的水溶液呈堿性的元素是________。
(8)最穩定的氣態氫化物的化學式是________。
(9)最高價氧化物對應水化物的酸性最強的元素是_________。
(10)非金屬元素的氣態氫化物中含氫質量分數最高的元素是____,含氫質量分數最小的氣態氫化物的化學式是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】700℃時,向容積為![]() 的恒容密閉容器中充入一定量的CO和
的恒容密閉容器中充入一定量的CO和![]() ,發生如下反應:
,發生如下反應:![]() ,反應過程中測定的部分數據見表:
,反應過程中測定的部分數據見表:
反應時間/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列說法正確的是
A.保持其他條件不變,升高溫度,平衡時![]() ,則反應的
,則反應的![]()
B.反應在![]() 內的平均速率為
內的平均速率為![]()
C.保持其他條件不變,再向平衡體系中同時通入![]() ,達到新平衡前v(正)<v(逆)
,達到新平衡前v(正)<v(逆)
D.相同溫度下,若起始時向容器中充入![]() ,達到平衡時
,達到平衡時![]() 轉化率大于
轉化率大于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.pH=2的溶液:Na+、Fe2+、I-、NO3-
B.c(AlO2-)=0.1 mol·L-1的溶液:K+、Na+、OH-、SO42-
C.![]() =0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
=0.1 mol·L-1的溶液:Na+、NH4+、SiO32-、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Mg2+、NH4+、Cl-、SCN-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種熔鹽捕獲CO2的裝置如圖所示。該裝置工作時,下列說法正確的是( )

A.a為電源的負極
B.x極使用石墨不會損耗
C.y極電極反應式為CO32-+4e-=C+3O2-
D.電路中轉移1 mol e-,理論上可捕獲5.6 L CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過對陽極泥的綜合處理可以回收寶貴的金屬,一種從銅陽極泥(主要成分為Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分離Ag、Se和Cu的新工藝流程如圖所示:
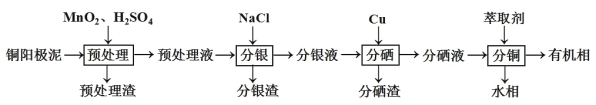
(1)已知預處理溫度為80℃,預處理渣中幾乎不含有單質S,則預處理時Cu2S發生反應的離子方程式為___。從環保角度來看,本工藝中采用稀H2SO4添加適量MnO2做預處理劑與傳統工藝中采用濃硫酸作氧化劑相比的主要優點是___。
(2)回收分銀渣中的銀,可用如圖過程:
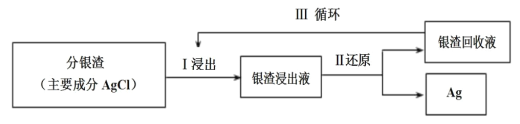
已知:S2O![]() -易與銀離子發生絡合反應:Ag++2S2O
-易與銀離子發生絡合反應:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常溫下,上述絡合反應的平衡常數為:K穩[Ag(S2O3)
。在常溫下,上述絡合反應的平衡常數為:K穩[Ag(S2O3)![]() ]=
]=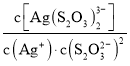 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中發生的離子反應方程式為:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),則常溫下此反應的平衡常數K為___(結果保留二位小數)。
(aq)+Cl-(aq),則常溫下此反應的平衡常數K為___(結果保留二位小數)。
②Ⅲ中銀渣回收液可直接循環使用,但循環多次后,銀的浸出率會降低。從化學平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亞硒酸(H2SeO3)。已知常溫下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,則NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亞硒酸得到,該反應化學方程式為___。
(4)分銅得到產品CuSO4·5H2O的具體操作如圖:

其中萃取與反萃取原理為:2RH+Cu2+![]() R2Cu+2H+,反萃取劑最好選用___(填化學式)溶液。
R2Cu+2H+,反萃取劑最好選用___(填化學式)溶液。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在四個不同的容器中,在不同的條件下進行合成氨反應:N2(g)+3H2(g)![]() 2NH3(g),根據下列在相同時間內測定的結果判斷,生成氨的速率最快的是
2NH3(g),根據下列在相同時間內測定的結果判斷,生成氨的速率最快的是
A.v(H2)=0.2mol·L-1·min-1
B.v(N2)=0.2 mol·L-1·min-1
C.v(N2)=0.02 mol·L-1·s-1
D.v(H2)= 0.04 mol·L-1·s-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com