
【題目】設NA為阿伏伽德羅常數的值.下列說法正確的是
A.0.2molAl與足量NaOH溶液反應,生成的H2分子數為0.3NA
B.常溫下,1LpH=1的鹽酸溶液,由水電離的H+離子數目為0.1NA
C.標準狀況下,0.1mol氯仿的體積為2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反應中,6molCuSO4能氧化白磷的分子數為1.1NA
【答案】A
【解析】
A.1mol鋁與足量NaOH溶液反應生成1.5mol氫氣,則0.2mol鋁反應生成0.3mol氫氣,即0.3NA個氫氣分子,故A正確;
B.常溫下,1LpH=1的鹽酸溶液中含有氫離子的物質的量濃度為0.1mol/L,氫離子抑制了水的電離,則溶液中的氫氧根離子是水電離的,水電離的氫離子濃度為1×10-13mol/L,1L該溶液中由水電離的氫離子的物質的量為1×10-13mol,故B錯誤;
C、標況下,氯仿為液態,不能根據氣體摩爾體積來計算,故C錯誤;
D、Cu元素的化合價由+2價降低到+1價,CuSO4是氧化劑,P4部分磷元素由0價降低到-3價,部分磷元素由0價升高到+5價,磷元素的化合價既升高又降低,所以P4既是氧化劑又是還原劑,若有11molP4參加反應,其中5molP4做氧化劑,60mol硫酸銅做氧化劑,只有6mol的P4做還原劑,則由電子守恒可知,有60mol的CuSO4參加反應,則被硫酸銅氧化的白磷分子的物質的量為![]() =
=![]() mol,故D錯誤;
mol,故D錯誤;
故選A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】關于下列裝置的說法中正確的是( )

A. 裝置①中,鹽橋中的Cl- 移向H2SO4溶液
B. 裝置②工作一段時間后,可加適量的Cu(OH)2恢復原溶液(原CuSO4溶液足量)
C. 裝置①②中的溶液內的H+都在銅電極上被還原,有氣泡產生
D. 裝置②工作一段時間后,b極附近溶液的pH降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在水溶液中橙紅色的Cr2O72—與黃色的CrO42—有下列平衡關系:Cr2O72—+H2O![]() 2CrO42—+2H+現將一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+現將一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入濃硫酸溶液,溶液呈_________色,因為_____________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4為黃色沉淀),則平衡向__________方向移動(正或逆),溶液顏色將__________(加深或變淺)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常溫下,取體積比為4:1的甲烷和H2的混合氣體112L(標準狀況下),經完全燃燒后恢復到常溫,則放出的熱量為
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的電解裝置中,A池盛有200mL飽和KCl溶液,B池盛有200mL飽和CuSO4溶液,a、b、c、d均為石墨電板,通電一段時間后,B池中陰極增重0.64g。
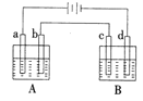
(1)A池中陽極的電極反應式為________。
(2)計算通電過程中A、B兩池陽極分別產生氣體的體積(標準狀況下)__________、_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】富鐵鋁土礦![]() 主要含有
主要含有![]() 、
、![]() 、FeO和
、FeO和![]() 可制備新型凈水劑液體聚合硫酸鋁鐵
可制備新型凈水劑液體聚合硫酸鋁鐵![]() 研究發現,當
研究發現,當![]() 時凈水效果最好.工藝流程如下
時凈水效果最好.工藝流程如下![]() 部分操作和產物略
部分操作和產物略![]() :
:
![]()
![]() 與
與![]() 發生反應的離子方程式是 ______ .
發生反應的離子方程式是 ______ .
![]() 測得濾液中
測得濾液中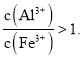 加入
加入![]() 和
和![]() 的作用是
的作用是![]() 結合化學用語說明
結合化學用語說明![]() ______ .
______ .
![]() 將溶液A電解得到液體聚合硫酸鋁鐵.裝置如圖所示
將溶液A電解得到液體聚合硫酸鋁鐵.裝置如圖所示![]() 陰離子交換膜只允許陰離子通過,電極為惰性電極
陰離子交換膜只允許陰離子通過,電極為惰性電極![]()
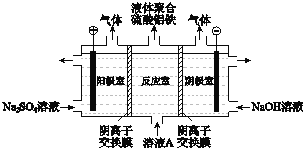
![]() 陰極室的電極反應式是 ______ .
陰極室的電極反應式是 ______ .
![]() 電解過程陽極室溶液pH的變化是 ______
電解過程陽極室溶液pH的變化是 ______ ![]() 填“增大”、“減小”或“不變”
填“增大”、“減小”或“不變”![]() .
.
![]() 簡述在反應室中生成液體聚合硫酸鋁鐵的原理 ______ .
簡述在反應室中生成液體聚合硫酸鋁鐵的原理 ______ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向1L密閉容器中加入1 mol HI(g),發生反應2HI(g) ![]() H2(g)+I2(g),H2物質的量隨時間的變化如圖所示。
H2(g)+I2(g),H2物質的量隨時間的變化如圖所示。

(1)0~2 min內的平均反應速率v(HI)=______________________。 該溫度下,H2(g)+I2(g) ![]() 2HI(g)的平衡常數K=________。
2HI(g)的平衡常數K=________。
(2)相同溫度下,若開始加入HI(g)的物質的量是原來的2倍,則_________原來的2倍。
a.平衡常數 b.HI的平衡濃度
c.達到平衡的時間 d.平衡時H2的體積分數
(3)實驗室用Zn和稀硫酸制取H2,反應時溶液中水的電離平衡________移動(填“向左”、“向右”或“不”);若加入少量下列試劑中的_______,產生H2的速率將增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固體酸燃料電池以CsHSO4固體為電解質傳遞H+,其基本結構如圖,電池總反應可表示為2H2+O2===2H2O,下列有關說法正確的是___________

A.電子通過外電路從b極流向a極
B.b極上的電極反應式為:O2+2H2O+4e-=4OH-
C.每轉移0.1mol電子,消耗1.12L的H2
D.H+由a極通過固體酸電解質傳遞到b極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來食品安全問題成為社會各界日益關注的焦點話題.香港地區食環署食物安全中心曾對十五個桂花魚樣本進行化驗,結果發現十一個樣本中含有孔雀石綠。孔雀石綠是化工產品,具有較高毒性,高殘留,且長期服用后,容易致癌、致畸,對人體有害。其結構簡式如圖所示。下列關于孔雀石綠的說法正確的是( )
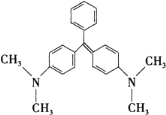
A.孔雀石綠的分子式為C23H25N2
B.1mol孔雀石綠在一定條件下最多可與6molH2發生加成反應
C.孔雀石綠屬于芳香烴
D.孔雀石綠苯環上的一氯取代物有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 代表阿伏加德羅數的數值,下列說法中正確的是
代表阿伏加德羅數的數值,下列說法中正確的是![]()
![]()
A.![]() 的
的![]() 溶液中
溶液中![]() 的數目為
的數目為![]()
B.![]() 分子中碳原子之間共用電子對數為
分子中碳原子之間共用電子對數為![]()
C.電解精煉銅時,若陰極得到電子數為![]() 個,則陽極質量減少64g
個,則陽極質量減少64g
D.標準狀況下,![]() 完全溶于水轉移電子數為
完全溶于水轉移電子數為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com