
室溫下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的變化曲線如圖所示,下列說法正確的是
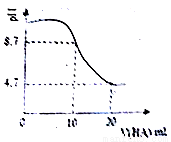
A.a點所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.b點所示溶液中c(A—)> c(HA)
C.a、b兩點所示溶液中水的電離程度相同
D.pH=7時,c(Na+)= c(A—)+ c(HA)
 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案科目:高中化學 來源:2015-2016學年廣東汕頭金山中學高二下第十二周練化學卷(解析版) 題型:選擇題
下列說法正確的是
A.冰熔化時,分子中H-O鍵發生斷裂
B.隨著鹵素原子電子層數的增加,鹵化物CX4分子間作用力逐漸增大,所以它們相應的熔沸點也逐漸增高
C.由于H—O鍵比H—S鍵牢固,所以水的熔沸點比H2S高
D.在由分子所構成的物質中,分子間作用力越大,該物質越穩定
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽黃山屯溪一中高二下期中理科化學試卷(解析版) 題型:選擇題
下列各組液體混合物,能用分液漏斗分離的是
A.溴苯和溴 B.正己烷和水 C.苯和硝基苯 D.乙醇和水
查看答案和解析>>
科目:高中化學 來源:2016屆西藏日喀則一中高三下學期二模考試理綜化學試卷(解析版) 題型:選擇題
第三周期元素R,它的原子最外電子層達到穩定結構所所需的電子數少于次外層與最內層電子數之差,且等于最內層電子數的整數倍,關于R的敘述中正確的是( )
A.常溫下,能穩定存在的R的氧化物都是酸性氧化物
B.R的氣態氫化物的水溶液具有強酸性
C.R是金屬元素
D.R的氣態氧化物不能在氧氣中燃燒
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三第二輪訓練三化學試卷(解析版) 題型:填空題
氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
(1)氨的水溶液顯弱堿性,其原因為 (用離子方程式表示),0.1mol•L?1的氨水中加入少量的NH4Cl固體,溶液的PH (填“升高”或“降低”);若加入少量的明礬,溶液中的NH4+的濃度 (填“增大”或“減小”)。
(2)硝酸銨加熱分解可得到N2O和H2O, 250℃時,硝酸銨在密閉容器中分解達到平衡,該分解反應的化學方程式為 ,平衡常數表達式為 ;若有1mol硝酸銨完全分解,轉移的電子數為 mol。
(3)由N2O和NO反應生成N2和NO2的能量變化如圖所示,若生成1molN2,其△H= kJ·mol?1。
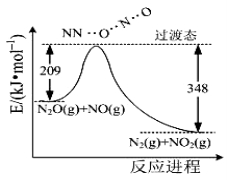
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏六盤山高中高三第四次模擬理綜化學試卷(解析版) 題型:簡答題
I.下列有關敘述正確的是( )
A.堿性鋅錳電池中,MnO2是催化劑
B.銀鋅紐扣電池工作時,Ag2O被還原為Ag
C.放電時,鉛酸蓄電池中硫酸濃度不斷增大
D.電鍍時,待鍍的金屬制品表面發生還原反應
II. 鋅是一種應用廣泛的金屬,目前工業上主要采用“濕法”工藝冶煉鋅.某含鋅礦的主要成分為ZnS(還含少量FeS等其他成分),以其為原料冶煉鋅的工藝流程如圖所示:

回答下列問題:
(1)硫化鋅精礦的焙燒在氧氣氣氛的沸騰爐中進行,所產生焙砂的主要成分的化學式為______________。
(2)焙燒過程中產生的含塵煙氣可凈化制酸,該酸可用于后續的______________操作.
(3)浸出液“凈化”過程中加入的主要物質為______________,其作用是______________。
(4)電解沉積過程中的陰極采用鋁板,陽極采用Pb-Ag合金惰性電極,陽極逸出的氣體是______________。
(5)改進的鋅冶煉工藝,采用了“氧壓酸浸”的全濕法流程,既省略了易導致空氣污染的焙燒過程,又可獲得一種有工業價值的非金屬單質.“氧壓酸浸”中發生的主要反應的離子方程式為______________。
(6)我國古代曾采用“火法”工藝冶煉鋅.明代宋應星著《天工開物》中有關“升煉倭鉛”的記載:“爐甘石十斤,裝載入一尼罐內,…,然后逐層用煤炭餅墊盛,其底鋪薪,發火鍛紅,…,冷淀,毀罐取出,…即倭鉛也.”該煉鋅工藝主要反應的化學方程式為______________(注:爐甘石的主要成分為碳酸鋅,倭鉛是指金屬鋅)。
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏六盤山高中高三第四次模擬理綜化學試卷(解析版) 題型:選擇題
下列表述不正確的是鹽橋中的移向溶液
A | B | C | D |
|
|
|
|
鹽橋中的Cl-移向ZnSO4溶液 | a極附近產生的氣體能使濕潤的淀粉碘化鉀試紙變藍 | 粗銅的電極反應式為: Cu2++2e-=Cu | 正極反應式為: O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省高一下期中化學試卷(解析版) 題型:填空題
氮是重要的非金屬元素,單質用途之一是制取氨氣,反應方程式為:
N2(g)+3H2(g)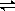 2NH3(g);回答下列問題:
2NH3(g);回答下列問題:
(1)氮元素在元素周期表的位置為______________,N2的結構式為______________
(2)在一個容積為2L的密閉容器中上述反應。反應開始時,各物質的量分別為:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。
v表示反應速率,下列正確的是______________
A.2min末時n(NH3)=2.0molB.v(N2)=0.25mol·L-1·min-1
C.v(NH3)=1.0mol·L-1·min-1D.2min末時N2的濃度為0.5mol·L-1
(3)在350℃、30MPa下合成氨氣時,n(NH3)和n(H2)(n表示物質的量)隨時間變化的關系如下圖所示,下列正確的是______________。
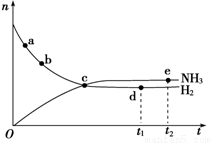
A.點a的正反應速率比點b的大
B.點c處反應達到平衡
C.點d(t1時刻)和點e(t2時刻)處n(N2)不一樣
D.其他條件不變,如果加入適當催化劑可以使該反應加快
(4)氮可以形成多種離子和分子,如N3-、NH2-、N2H4、N2H5+、N2H62+等,已知N2H5+、N2H62+是中性分子N2H4結合質子生成的,有與NH4+相似的性質。
①寫出N2H5+與強堿反應的離子方程式為:______________。
②在火箭推進器中裝有還原劑肼(N2H4)和強氧化劑H2O2,兩者反應生成兩種不污染環境的物質。寫出N2H4電子式______________,該反應的化學方程式為______________。
③寫出與N3-電子數相等的一種分子的分子式______________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高一下期中化學試卷(解析版) 題型:選擇題
NA為阿伏加德羅常數,下列敘述錯誤的是( )
A.46gNO2和N2O4混合氣體中含有原子總數為3NA
B.常溫常壓下,Cu-Zn原電池中,正極產生1.12LH2時,轉移的電子數應小于0.1NA
C.12g金剛石中含有的共價鍵數為2NA
D.2.1gDTO中所含中子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com