
【題目】韓國三星公司因為手機電池爆炸而屢屢曝光,電池的安全性和環保性再次被公眾所重視。一種以引火性高的聯氨(N2H4)為燃料的環保電池,工作時產生穩定無污染的物質,原理如圖所示。下列說法正確的是

A. N極為電源負極,聯氨從c口通入
B. 負極上每消耗lmol N2H4,轉移6mol電子
C. 正極的電極反應式為:O2+2H2O+4e-==4OH-
D. 可將聯氨改進為引火性低、穩定性好的N2H4·H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】當物質發生化學反應時,斷開反應物中的化學鍵要__________能量,而形成生成物中的化學鍵要__________能量,一個確定的化學反應的能量變化決定于反應物的總能量與生成物的總能量的相對大小。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】要證明某溶液中不含Fe3+而可能含有Fe2+,則進行如下實驗操作的最佳順序為( )
①加入少量氯水 ②加入少量KMnO4溶液 ③加入少量KSCN
A. ①③ B. ③② C. ③① D. ①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工業廢料料中含有Cr(OH)3、Al2O3、CuO、NiO等物質,工業上通過下列流程回收其中有用的金屬和制取Na2Cr2O7。
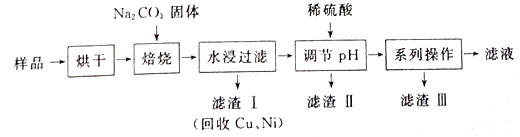
已知:
①“水浸過濾”后的溶液中存在Na2CrO4、NaAlO2等物質
②除去濾渣II后,溶液中存在反應2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③Na2Cr2O7、Na2CrO4在不同溫度下的溶解度(g/100 g H2O)如下表:
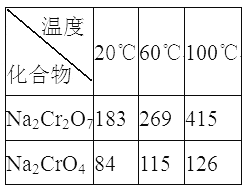
(1)“焙燒”過程中生成NaAlO2化學方程式為_____________________。
(2)生成濾渣II時,需加入適量稀硫酸調節溶液的pH除去A1O2-。若稀硫酸過量,則因過量引起反應的離子方程式為______________________。
(3)“系列操作”為:繼續加入稀硫酸、_____、冷卻結晶、過濾。繼續加入稀硫酸的目的是_____________,濾渣III的主要成分是_________(填化學式)。
(4)工業上還可以在“水浸過濾’’后的溶液中加人適量稀硫酸,用石墨作電極電解生產金屬鉻,陰極的電極反應式為______________。
(5)流程圖最后的“濾液”中仍然有殘留的Na2Cr2O7。Cr為重金屬元素,若含量過高就排入河流中,會對河水造成重金屬污染。為測定“濾液”中的c(Na2Cr2O7),某實驗小組取“濾液”20mL,水稀釋至250 mL,再取稀釋后的溶液25 mL于錐形瓶中,用c mol L-1的FeSO4溶液進行氧化還原滴定,到終點時消耗FeSO4溶液體積為V mL[已知發生的反應為Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],則“濾液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],則“濾液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將氯化鈉、氯化銨、氯化鐵、氯化鎂四種溶液,通過一步實驗就能加以區別,并只用一種試劑,這種試劑是:
A. NaOH B. HCl C. KSCN D. BaCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩個體積相同的容器一個盛有CO2,另一個盛有N2和O2,在同溫同壓下兩容器內的氣體一定具有相同的()
A. 原子總數
B. 質子總數
C. 分子總數
D. 質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中發生如下反應:mA(g)+nB(g) ![]() pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的1/2,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的1/2,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
A. ![]() B. 平衡向逆反應方向移動
B. 平衡向逆反應方向移動
C. A的轉化率減小 D. C的體積分數增加
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com