
【題目】一定溫度時,向2.0L恒容密閉容器中充入2molSO2和1molO2 , 發生反應:2SO2(g)+O2(g)2SO3(g).經過一段時間后達到平衡.反應過程中測定的部分數據見下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列說法正確的是( )
A.反應在前t1s的平均速率v(O2)=0.4/t1molL﹣1s﹣1
B.保持其他條件不變,體積壓縮到1.0L,平衡常數將增大
C.保持溫度不變,向該容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , 則此時V正>V逆
D.相同溫度下,起始時向容器中充入4mol SO3 , 達到平衡時,SO3的轉化率大于10%
【答案】C
【解析】解:A.根據表格中數據知,當n(SO3)=1.8mol,該反應達到平衡狀態,反應在前t1s的平均速率v(SO3)= ![]() =0.4/t1molL﹣1s﹣1 , 再根據同一可逆反應中同一段時間內各物質的反應速率之比等于其計量數之比計算v(O2)=0.2/t1molL﹣1s﹣1 , 故A錯誤;
=0.4/t1molL﹣1s﹣1 , 再根據同一可逆反應中同一段時間內各物質的反應速率之比等于其計量數之比計算v(O2)=0.2/t1molL﹣1s﹣1 , 故A錯誤;
B.化學平衡常數只與溫度有關,溫度不變,化學平衡常數不變,與壓強、物質濃度都無關,故B錯誤;
C.反應達到平衡狀態時,c(SO3)= ![]() =0.9mol/L,c(SO2)=
=0.9mol/L,c(SO2)= ![]() mol/L=0.1mol/L,c(O2)=
mol/L=0.1mol/L,c(O2)= ![]() mol/L=0.05mol/L,化學平衡常數K=
mol/L=0.05mol/L,化學平衡常數K= ![]() =1620,
=1620,
向該容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , c(SO3)=(0.9+ ![]() )mol/L=1mol/L、c(SO2)=(0.1+
)mol/L=1mol/L、c(SO2)=(0.1+ ![]() )mol/L=0.25mol/L,c(O2)=(0.05+
)mol/L=0.25mol/L,c(O2)=(0.05+ ![]() )mol/L=0.1mol/L,濃度商=
)mol/L=0.1mol/L,濃度商= ![]() =160<1620,則該反應向正反應方向移動,則此時V正>V逆 , 故C正確;
=160<1620,則該反應向正反應方向移動,則此時V正>V逆 , 故C正確;
D.相同溫度下,起始時向容器中充入4mol SO3 , 如果三氧化硫完全轉化為二氧化硫和氧氣,二氧化硫和氧氣的物質的量分別是4mol、2mol,為原來的2倍,增大壓強平衡正向移動,則二氧化硫轉化率增大,所以二氧化硫轉化率大于90%,相同溫度下,起始時向容器中充入4mol SO3 , 達到平衡時,SO3的轉化率小于10%,故D錯誤;
故選C.
A.先計算三氧化硫反應速率,再根據同一可逆反應中同一段時間內各物質的反應速率之比等于其計量數之比計算v(O2);
B.化學平衡常數只與溫度有關,溫度不變,化學平衡常數不變;
C.先計算濃度商,根據濃度商與化學平衡常數相對大小判斷反應方向,從而確定正逆反應速率相對大小;
D.相同溫度下,起始時向容器中充入4mol SO3 , 如果三氧化硫完全轉化為二氧化硫和氧氣,二氧化硫和氧氣的物質的量分別是4mol、2mol,為原來的2倍,增大壓強平衡正向移動,則二氧化硫轉化率增大.


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案 小學期末標準試卷系列答案
小學期末標準試卷系列答案科目:高中化學 來源: 題型:
【題目】現有碳酸鈉和碳酸氫鈉的固體混合物,先取m g固體樣品進行加熱,完全分解產生CO2氣體112 mL;另取m g固體樣品溶于水,加入足量的鹽酸時產生CO2 448 mL(氣體體積均為標準狀況下測定)。
(1)求m g混合物中碳酸氫鈉與碳酸鈉的物質的量各是多少?_________
(2)若產生448 mL CO2時,消耗鹽酸的體積為300mL,則該鹽酸的物質的量濃度是多少?____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾嚴重影響人們的生活,霧霾的形成與汽車排放的 NOx等有毒氣體有關.
(1)可以通過活性炭處理汽車尾氣,原理為:C(s)+2NO(g)N2(g)+CO2(g)△H<0.
①下列情況能說明該反應達到平衡狀態的是
A.2ν正(NO)=ν逆(CO2)
B.在恒溫、恒容的容器中,混合氣體的壓強保持不變
C.在絕熱、恒容的容器中,反應的平衡常數不再變化
D.在恒溫、恒壓的容器中,混合氣體的密度保持不變
②在恒溫、恒容條件下,加入2mol C(s)和2mol NO(g)達平衡后,再在絕熱、恒容條件下,加入1mol NO重新達平衡后,N2的百分含量將(填“增大”、“減小”、“不變”).
(2)臭氧是理想的煙氣脫硝試劑,原理為:2NO2(g)+O3(g)N2O5(g)+O2(g).
若在容積為10L的密閉容器中進行該反應,起始時充入0.4molNO2、0.2mol O3 , 反應在不同條件下進行,反應體系總壓強隨時間的變化如圖1所示.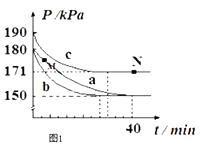
①實驗a從開始至平衡時的反應速率v(O3)=;實驗c中NO2的平衡轉化率為 .
②與實驗a相比,其他兩組改變的實驗條件分別是:b , c .
③M點的逆反應速率 v(逆)N點的正反應速率v(正) (填“>”、“<”或“=”).
④若在N點時,維持溫度和壓強不變,t1時再加入0.4molNO2、0.2mol O3 , 請在圖中畫出逆反應速率在t1后隨時間t的變化曲線圖2 . 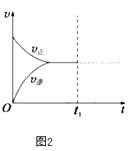
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y、Z三種金屬,X、Y組成原電池,X是負極;把Z放入X的硝酸鹽溶液中,Z表面有X析 出.三者的金屬活動性順序是( )
A.X>Y>Z
B.Z>X>Y
C.X>Z>Y
D.Y>X>Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2L的密閉容器中,加入1molX(g)和2molY(g)發生反應:X(g)+mY(g)3Z(g),平衡時,X,Y,Z的體積分數分別為30%、60%、10%,在此平衡體系中加入1molZ(g),再將達到平衡后,X,Y,Z的體積分數不變.下列敘述不正確的是( )
A.m=2
B.兩次平衡的平衡常數相同
C.X與Y的平衡轉化率之比為1:1
D.第二次平衡時,Z的濃度為0.4molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質在水中的電離方程式書寫正確的是
A. Al2(SO4)3===2Al3++3SO![]() B. NaHCO3===Na++H++CO32-
B. NaHCO3===Na++H++CO32-
C. CH3COOH===CH3COO- + H+ D. KClO3===K++Cl-+3O2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某研究性學習小組設計制取氯氣并以氯氣為原料進行特定反應的裝置.
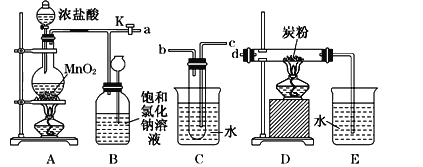
(1)寫出實驗室制取氯氣的離子方程式________________________________________;
(2)要將C裝置接入B和D之間,正確的接法是:a→____→____→d;
(3)實驗開始先點燃A處的酒精燈,打開旋塞K,讓Cl2充滿整個裝置,再點燃D處的酒精燈,Cl2通過C裝置后進入D,D裝置內盛有碳粉,發生氧化還原反應,生成CO2和HCl(g),發生反應的化學方程式為______.
(4)D處反應完畢后,關閉旋塞K,移去兩個酒精燈,由于余熱的作用,A處仍有少量Cl2產生,此時B中的現象是______,B的作用是______.
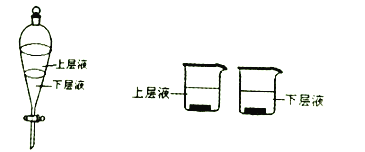
(5)用量筒量取20mL E中溶液,倒入已檢查完氣密性良好的分液漏斗中,然后再注入10mL CCl4,蓋好玻璃塞,振蕩,靜置于鐵架臺上(如圖),等分層后取上層液和下層液,能使有色布條褪色的是______(填“上層液”或“下層液”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中,錯誤的是
A. 分液時,分液漏斗下層液體從下口放出,上層液體從上口倒出。
B. 蒸餾時,應使溫度計水銀球靠近蒸餾燒瓶支管口。
C. 可用酒精萃取溴水中的溴。
D. 稱量時,稱量物放在紙上,置于托盤天平的左盤。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com