
【題目】下列說法錯誤的是
A. 0.1mol/L的Na2CO3溶液加適量水稀釋后,溶液中![]() 變大
變大
B. 若使Na2S溶液中![]() 接近于2︰1,可加入適量的KOH固體
接近于2︰1,可加入適量的KOH固體
C. 25℃時,濃度均為0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O)
D. 0.2 mol/L CH3COOH溶液與0. 1mol/L NaOH溶液等體積混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH)
【答案】C
【解析】
A. Na2CO3溶液加適量水稀釋后,促進水解,所以氫氧根離子濃度變大,碳酸根離子濃度減小,所以溶液中![]() 變大,則
變大,則![]() 變大,所以A選項是正確的;
變大,所以A選項是正確的;
B、適量KOH固體,水解平衡向著逆向移動,使得S2-的物質的量增大,而鈉離子的物質的量不變,從而可使Na2S溶液中![]() 接近于2:1,所以B選項是正確的;
接近于2:1,所以B選項是正確的;
C、混合溶液中,氫氧化鈉和一水合氨的混合比例未知,故無法判斷c(Na+)= c(NH3·H2O),故C錯誤;
D、0.2 mol/L CH3COOH溶液與0. 1mol/L NaOH溶液等體積混合后,得到等物質的量濃度的醋酸和醋酸鈉的混合溶液,根據物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),根據電荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因此可得:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH),所以D選項是正確的。
故選C。


科目:高中化學 來源: 題型:
【題目】某校學生化學實驗小組,為驗證非金屬元素氯的氧化性強于硫和氮,設計了一套實驗裝置:(部分夾持裝置已略去)
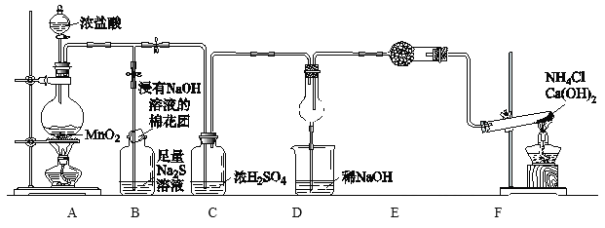
(1)寫出A中反應的離子方程式___________________________。
(2)寫出F中反應的化學方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出現現象_______________,寫出B中發生的離子反應_________________。
(4)E中干燥管裝的干燥劑是________,檢驗F中氣體的方法______________。
(5)D中干燥管中出現的現象______________,D中干燥管中化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,其中所列數字分別代表某一元素。

請你根據表中所給元素,回答下列問題:
(1)表中屬于d區的元素是_________(填編號)。
(2)⑤⑥⑦三種元素中電負性最大的是_____(填寫元素符號),在第二周期中第一電離能介于②和③之間的元素有_______種;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一種常見的干燥劑,它的電子式為_____________。
(5)寫出下列有關反應的離子方程式:⑩的單質與元素③的最高價氧化物,對應的水化物的稀溶液反應:___________________________。
(6)⑥和⑦相比較,非金屬性較弱的是______(填元素符號),可以驗證你的結論的是下列中的_____(填編號)。
a.氣態氫化物的穩定性; b.兩元素的電負性;c.含氧酸的酸性; d. 最高化合價
(7)①與③的元素形成的10電子中性分子X的空間構型為_____,它極易溶于水中,請簡要說明該物質易溶于水的原因_______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)X射線衍射測定等發現,I3AsF6中存在I3+離子。I3+離子的幾何構型為_____,中心原子的雜化類型為_____。
(2)CS2分子中,C原子的雜化軌道類型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子構型為_____,其中氧原子的雜化方式為_____。
(4)CH3COOH中C原子軌道雜化類型為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鉬在工業和國防建設中有重要的作用。鉬(Mo)的常見化合價為+6、+5、+4。由鉬精礦(主要成分是MoS2)可制備單質鉬和鉬酸鈉晶體(Na2MoO4·2H2O),部分流程如圖1所示:
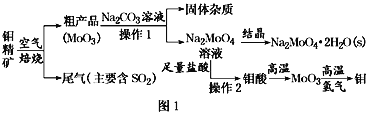
已知:鉬酸微溶于水,可溶于液堿和氨水。
回答下列問題:
(1)焙燒鉬精礦時發生的化學方程式為_____________________________。
(2)鉬精礦焙燒時排放的尾氣對環境的主要危害是___________________,請提出一種實驗室除去該尾氣的方法____________________________________。
(3)操作2的名稱為________。由鉬酸得到MoO3所用到的硅酸鹽材料儀器的名稱是________。
(4)焙燒鉬精礦所用的裝置是多層焙燒爐,圖2為各爐層固體物料的物質的量的百分數(φ)。
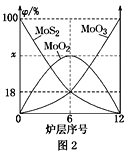
①x=________。
②焙燒爐中也會發生MoS2與MoO3反應生成MoO2和SO2的反應,若該反應轉移6mol電子,則消耗的氧化劑的化學式及物質的量分別為________、________。
(5)操作1中,加入碳酸鈉溶液充分反應后,堿浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在結晶前需加入Ba(OH)2固體以除去溶液中的SO42-。當BaMoO4開始沉淀時,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液體積變化可忽略不計]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池的充放電反應為Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某鉛蓄電池的正、負極標記被磨損,試用如困裝置設計實驗,識別出此鉛蓄電池的正、負極。
2PbSO4(s)+2H2O(1)。某鉛蓄電池的正、負極標記被磨損,試用如困裝置設計實驗,識別出此鉛蓄電池的正、負極。
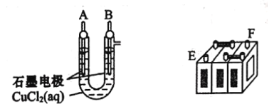
(1)將A接E、B接F,B電極出現_____________現象,電極反應式為_____________,說明F為正極。
(2)鉛蓄電池工作時(放電),E電極的反應式為_____________,充電時該極與外接電源的_____________極相連。
(3)若有0.2mol電子發生轉移,則正極消耗PbO2的物質的量是______mol。
(4)如圖是在金屬鋅板上貼上一張用某溶液浸濕的濾紙。
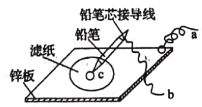
①若用硫酸鈉和酚酞的混合溶液浸濕濾紙,用導線將a、b直接相連,則濾紙出現____色,鉛筆芯c點處的電極反應式為________________。
②若用KI-淀粉溶液浸濕濾紙,用導線將a、b與鉛蓄電池的E、F電極相連,鉛筆芯c點處出現藍色,則b接的是_______(填“E”或“F”)電極。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)工業上常用蘇打燒結法提取自然界中的稀散元素硒(Se),我國科研人員自主設計的利用粗銅電解精煉所產生含硒化亞銅(Cu2Se)和碲化亞銅(Cu2Te)的陽極泥為原料,提取硒的某種工藝流程如圖所示。

回答下列問題:
(1)電解精煉銅時,電源的正極連接_______(填“粗銅”或“精銅”),陽極溶解銅的質量__________(填“>”“=”或“<”)陰極析出銅的質量。
(2)“燒結”時蘇打和硒化亞銅主要生成了Na2SeO3、Cu2O和CO2氣體,該反應的化學方程式為________________________________。“燒結”時生成了少部分Na2SeO4,寫出“還原”時反應的離子方程式____________。
(3)含硒燒結物浸取時,最佳加熱方式為________________,除去的物質為___________(填化學式)。
(4)本工藝副產物TeO2用于制造紅外器件、聲光器件材料,可溶于強酸和強堿,并形成復鹽,則TeO2屬于______氧化物(填“酸性”“堿性”或“兩性”)。
(5)把硫酸工業第一步的產物SO2通入Na2SeO3溶液制備硒單質,寫出該反應的離子方程式_____________。若得到50 kg硒單質,至少需要___________kg質量分數為90%的FeS2礦石。(結果保留一位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,現有濃度均為0.10mol/L的三種溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。請回答:
(1)三種溶液中,pH>7的是__________(填序號),其原因是________________________________________(用離子方程式表示)。pH<7的是__________(填序號),其原因是________________________________________(用化學用語表示)。
(2)下列說法正確的是__________(填序號)。
a.CH3COONa是弱電解質
b.CH3COONa和CH3COOH都能促進水的電離
c.①②兩種溶液等體積混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③兩種溶液等體積混合后,溶液pH<7,該混合溶液中離子濃度大小關系是_____________________
(4) 25℃時,電解1.00L飽和NaCl溶液一段時間后,收集到1.12LH2(標準狀況)。該反應的離子方程式是____________,此時溶液的pH是____________(不考慮溶液體積的變化)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甘氨酸亞鐵![]() 是一種補鐵強化劑。實驗室利用
是一種補鐵強化劑。實驗室利用![]() 與甘氨酸
與甘氨酸![]() 制備甘氨酸亞鐵,實驗裝置如下圖所示(夾持和加熱儀器已省略)。
制備甘氨酸亞鐵,實驗裝置如下圖所示(夾持和加熱儀器已省略)。

查閱資料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亞鐵易溶于水,難溶于乙醇。
②檸檬酸易溶于水和乙醇,具有較強的還原性和酸性。
實驗過程:
I.裝置C中盛有17.4g![]() 和200mL1.0mol·L-1甘氨酸溶液。實驗時,先打開儀器a的活塞,待裝置c中空氣排凈后,加熱并不斷攪拌;然后向三頸瓶中滴加檸檬酸溶液。
和200mL1.0mol·L-1甘氨酸溶液。實驗時,先打開儀器a的活塞,待裝置c中空氣排凈后,加熱并不斷攪拌;然后向三頸瓶中滴加檸檬酸溶液。
Ⅱ.反應結束后過濾,將濾液進行蒸發濃縮;加入無水乙醇,過濾、洗滌并干燥。
(1)儀器a的名稱是________;與a相比,儀器b的優點是________。
(2)裝置B中盛有的試劑是:_______;裝置D的作用是________。
(3)向![]() 溶液中加入
溶液中加入![]() 溶液可制得
溶液可制得![]() ,該反應的離子方程式為________。
,該反應的離子方程式為________。
(4)過程I加入檸檬酸促進![]() 溶解并調節溶液pH,溶液pH與甘氨酸亞鐵產率的關系如圖所示。
溶解并調節溶液pH,溶液pH與甘氨酸亞鐵產率的關系如圖所示。
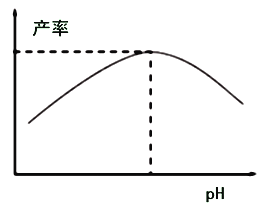
①pH過低或過高均導致產率下降,pH過高導致產率下降其原因是________;
②檸檬酸的作用還有________。
(5)過程II中加入無水乙醇的目的是________。
(6)本實驗制得15.3g甘氨酸亞鐵,則其產率是_______%。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com