
【題目】物質在水中可能存在電離平衡、水解平衡和沉淀的溶解平衡等,它們都可看作化學平衡。請根據所學的知識回答:
(1)0.1 mol·L-1的NaHSO3溶液的pH約為4.0,請分析NaHSO3溶液顯酸性的原因____。
(2)實驗室配制FeCl3溶液時,需將FeCl3溶解在較濃鹽酸中,然后加水稀釋,這樣操作的目的是____。
(3)KCN溶液中存在CN—+H2O![]() HCN+OH—,該反應在 25℃時的平衡常數K=____。(已知:25℃時,Ka(HCN)=6.25×10—10)
HCN+OH—,該反應在 25℃時的平衡常數K=____。(已知:25℃時,Ka(HCN)=6.25×10—10)
(4)已知25℃,Kb(NH3·H2O)=1.8×10-5,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11。則NH4HCO3溶液的pH____(填“>、<或=”)7。
(5)某地海水樣品經Na2FeO4處理后,所含離子及其濃度見下表所示(H+和OH—未列出)
離子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl— |
濃度/mol·L-1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a____0.16(填“>、<或=”)。
【答案】NaHSO3的電離程度大于其水解程度,故溶液顯酸性 抑制FeCl3水解 1.6×10—5 > >
【解析】
(1)NaHSO3是弱酸的酸式鹽,HSO3-存在電離平衡HSO3-![]() SO32-+H+,電離呈酸性;HSO3-存在水解平衡HSO3-+H2O
SO32-+H+,電離呈酸性;HSO3-存在水解平衡HSO3-+H2O![]() H2SO3+OH-,水解呈堿性,0.1 mol·L-1的NaHSO3溶液的pH約為4.0,說明NaHSO3的電離程度大于其水解程度,故溶液顯酸性;
H2SO3+OH-,水解呈堿性,0.1 mol·L-1的NaHSO3溶液的pH約為4.0,說明NaHSO3的電離程度大于其水解程度,故溶液顯酸性;
(2)FeCl3易水解,鹽酸抑制FeCl3水解,實驗室配制FeCl3溶液時,需將FeCl3溶解在較濃鹽酸中,然后加水稀釋;
(3)Ka(HCN)= 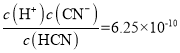 ;CN—+H2O
;CN—+H2O![]() HCN+OH—,在 25℃時的平衡常數K=
HCN+OH—,在 25℃時的平衡常數K=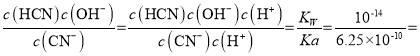 1.6×10—5;
1.6×10—5;
(4)已知25℃,Kb(NH3·H2O)=1.8×10-5,則NH4+的水解常數是![]() ,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11,則HCO3-的水解常數是
,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11,則HCO3-的水解常數是![]() ,HCO3-的水解程度大于NH4+的水解程度,所以溶液呈堿性,pH>7。
,HCO3-的水解程度大于NH4+的水解程度,所以溶液呈堿性,pH>7。
(5)根據電荷守恒,2c(SO42-)+ c(Cl-)+ c(OH-)= 2c(Mg2+)+ 3c(Fe3+)+ c(Na+)+ c(H+),2a+0.58+ c(OH-)=2×0.05+3×0.1+0.5+ c(H+),由溶液含有Fe3+可知,溶液呈酸性,c(OH-)<c(H+),所以a>0.16。


科目:高中化學 來源: 題型:
【題目】一定條件下,密閉容器中發生反應Mg)N(g),反應過程中的能量變化如圖中曲線所示,下列說法錯誤的是

A.該反應正反應活化能為E3-E2
B.該反應的△H=E1-E2
C.曲線Ⅱ表示其他條件不變,升高溫度時的能量變化
D.曲線Ⅲ表示其他條件不變,加入催化劑時的能量變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液均為![]() ,有關敘述正確的是( )
,有關敘述正確的是( )
A.碳酸氫鈉溶液中![]()
B.碳酸鈉溶液比碳酸氫鈉溶液的pH小
C.碳酸鈉溶液中![]()
D.碳酸鈉溶液中滴加鹽酸至pH=7,所得溶液的溶質只有NaCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述正確的是
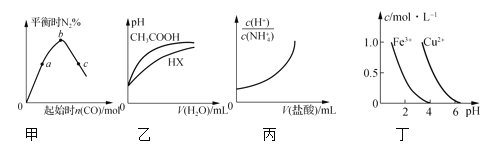
A.圖甲表示反應4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),保持其他條件不變,改變CO的物質的量,平衡時N2的體積分數變化情況。由圖可知,NO2的轉化率:c>b>a
N2(g)+4CO2(g),保持其他條件不變,改變CO的物質的量,平衡時N2的體積分數變化情況。由圖可知,NO2的轉化率:c>b>a
B.圖乙表示25℃時,分別加水稀釋體積均為100 mL、pH=2的CH3COOH溶液和HX溶液,則25℃時HX的電離平衡常數大于CH3COOH的電離平衡常數
C.圖丙表示25℃時,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1鹽酸,溶液隨鹽酸體積的變化關系
D.根據圖丁,若要除去CuSO4溶液中的Fe3+,需要調節溶液的pH在7左右
查看答案和解析>>
科目:高中化學 來源: 題型:
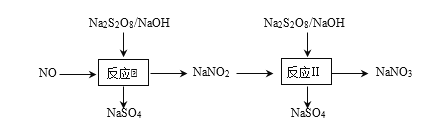
【題目】硝酸工業尾氣中含有NO,可以利用強氧化劑過硫酸鈉(Na2S2O8)氧化脫除NO,可以消除污染。
(1)NO3-空間構型為__________。
(2)O、N、S三種元素的第一電離能由小到大的順序為____________。
(3)在反應2中,NO2-的初始濃度為0.1 mol·L-1,反應為NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同溫度下,達到平衡時NO2-的脫除率與過硫酸鈉(Na2S2O8)初始濃度的關系如圖1所示。
NO3-+2SO42-+H2O。不同溫度下,達到平衡時NO2-的脫除率與過硫酸鈉(Na2S2O8)初始濃度的關系如圖1所示。
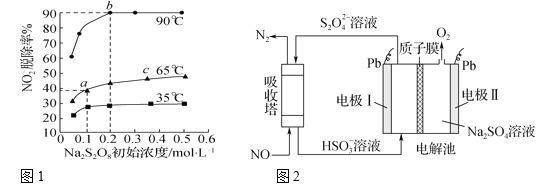
圖中點a、點b和點c的平衡常數K的大小關系____。
(4)間接電化學法可對大氣污染物NO進行無害化處理,其工作原理如圖2所示,質子膜允許H+和H2O通過。電極 Ⅰ 的電極反應式為____,每處理1 mol NO,可同時得到____g O2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N和S是重要的非金屬元素,聚氮化硫(SN)x是重要的超導材料,目前己成為全球材料行業研究的熱點。回答下列問題:
(1)下列電子排布圖能表示氮原子的最低能量狀態的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.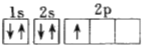
(2)S原子的基態原子核外有____個未成對電子,有__________種不同形狀的電子云。
(3) S、N、O三種元素的第一電離能由大到小的順序為________,列舉一種與SCN-互為等電子體的分子為_______。
(4) (CH3)3N中N原子雜化方式為_______;As與N是同主族元素,AsH3的相對分子質量比NH3大,實驗測得AsH3沸點比NH3低,其原因是___________。
(5) GaN是一種重要的半導體材料,其晶胞結構和金剛石類似,其晶胞結構如圖。
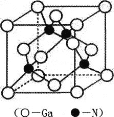
①氮化鎵中氮原子與鎵原子之間以_______鍵相結合,與同一個Ga原子相連的N原子構成的空間構型為_______。
②GaN晶體的晶胞邊長為a pm,摩爾質量為M g/mol,阿伏加德羅常數的值為NA,則GaN晶體的密度為_______gcm-3 (只要求列算式,不必計算出結果,1pm=l0-12m)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法一定正確的是
A.25℃,12.0gNaHSO4固體中含有的陽離子數目為0.2NA
B.T℃時,1LpH=6的純水中,含有的OH-數目為1×10-8NA
C.2.24LN2和NH3混合氣體中原子間含有的共用電子對數目為0.3NA
D.2molSO2和1molO2在一定條件下充分反應后,所得混合氣體的分子數大于2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】飽和食鹽水中加入碳酸氫銨可制備小蘇打,濾出小蘇打后,向母液中通入氨,再冷卻、加食鹽,過濾,得到氯化銨固體.下列分析錯誤的是( )
A.該制備小蘇打的方程式為:NaCl+NH4HCO3→NaHCO3↓+NH4Cl
B.母液中通入的氨氣與HCO3﹣反應:NH3+HCO3﹣→CO32﹣+NH4+
C.加食鹽是為增大溶液中Cl﹣的濃度
D.由題可知溫度較低時,氯化銨的溶解度比氯化鈉的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A.發生化學反應時失去電子越多的金屬原子,還原能力越強
B.活潑非金屬單質在氧化還原反應中只作氧化劑
C.陽離子只有氧化性,陰離子只有還原性
D.含有某元素最高價態的化合物不一定具有強氧化性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com