
【題目】標準狀況下,將3.36 L CO2氣體通入200 mL 1.00 mol·L-1NaOH溶液中,充分反應后溶液中c(CO32-)與c(HCO3-)的比值為(不考慮CO32-、HCO3-的水解) ( )
A.1∶1
B.1∶2
C.2∶1
D.1∶3
科目:高中化學 來源: 題型:
【題目】ClO2是一種國際公認的安全、無毒的綠色消毒劑,沸點11℃,凝固點-59℃。工業上,可用下列原理制備ClO2(液相反應):![]() 。設NA是阿伏伽德羅常數的值。下列說法正確的是( )
。設NA是阿伏伽德羅常數的值。下列說法正確的是( )
A.在標準狀況下,2240mL ClO2含有原子數為0.3NA
B.若生成1.5mol Na2SO4,則反應后的溶液中Fe3+數目為0.2NA
C.48.0g FeS2完全反應,則上述反應中轉移電子數為6NA
D.每消耗30mol NaClO3,生成的水中氫氧鍵數目為14NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則正確的關系式為
4NO(g)+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則正確的關系式為
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是課外活動小組的同學設計的4個噴泉實驗方案。下列有關操作不可能引發噴泉現象的是( )
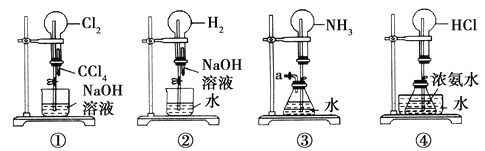
A. 擠壓裝置①的膠頭滴管使CCl4全部進入燒瓶,并打開止水夾
B. 擠壓裝置②的膠頭滴管使NaOH溶液全部進入燒瓶,并打開止水夾
C. 用鼓氣裝置從裝置③的a處不斷鼓入空氣,并打開止水夾
D. 向裝置④的水槽中慢慢加入足量濃硫酸,并打開止水夾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L恒容密閉容器中充入2 mol X和1mol Y發生反應:2X(g) +Y(g)![]() 3Z(g),反應過程持續升高溫度,測得X的體積分數與溫度的關系如圖所示。下列推斷正確的是 ( )
3Z(g),反應過程持續升高溫度,測得X的體積分數與溫度的關系如圖所示。下列推斷正確的是 ( )
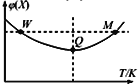
A. Q點時,Y的轉化率最大
B. 升高溫度,平衡常數增大
C. W點X的正反應速率等于M點X的正反應速率
D. 平衡時充入Z,達到新平衡時Z的體積分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液中微粒的物質的量濃度關系正確的是( )
A.25 ℃時,pH=7的NH4Cl與NH3·H2O混合溶液:c(H+)=c(OH-)=c(![]() )=c(Cl-)
)=c(Cl-)
B.25 ℃時,向10 mL pH=12的NaOH溶液中滴加等體積pH=2的CH3COOH溶液: c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1 mol·L-1的CH3COONa溶液與0.1 mol·L-1的CaCl2溶液等體積混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.濃度均為0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(![]() )的大小順序為③>②>①
)的大小順序為③>②>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組取一定質量的FeSO4固體,利用下圖裝置進行實驗。


已知:SO2熔點-72℃,沸點-10℃;SO3熔點16.8℃,沸點44.8 ℃。
(1)實驗③反應的離子方程式是_________________________。
(2)分解過程除產生使木條復燃的氣體外,僅由A中固體顏色變化推測,還一定有________氣體,依據是________________________________。
(3)實驗④反應的離子方程式是__________________________。
(4)某同學依據B中的現象,認為FeSO4分解一定有SO3生成。你認為是否正確,并說明原因:____________(用必要的文字和化學方程式解釋)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷單質及其化合物在工農業生產中有著廣泛的應用。
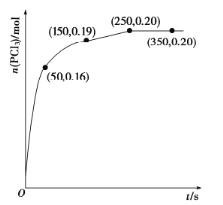
(1)溫度為![]() 時,向2.0L恒容密閉容器中充入1.0 mol
時,向2.0L恒容密閉容器中充入1.0 mol ![]() ,發生反應
,發生反應![]() ,經過一段時間后達到平衡,反應過程中測定的部分數據如下圖。反應在前50s的平均速率
,經過一段時間后達到平衡,反應過程中測定的部分數據如下圖。反應在前50s的平均速率![]() __________,反應達到平衡后,升高溫度,則
__________,反應達到平衡后,升高溫度,則![]() ______(填“增大”“減小”或“不變”),再次達到平衡后,
______(填“增大”“減小”或“不變”),再次達到平衡后,![]() 的平衡濃度為
的平衡濃度為![]() ,則反應的
,則反應的![]() _____(填“>”“=”或“<”)0。
_____(填“>”“=”或“<”)0。
(2)溫度為![]() 時,若平衡時體系的總壓強為p,該反應的平衡常數
時,若平衡時體系的總壓強為p,該反應的平衡常數![]() ______________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
______________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)溫度為![]() 時,上述反應若在恒壓容器中進行,則達到平衡后,
時,上述反應若在恒壓容器中進行,則達到平衡后,![]() 的物質的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
的物質的量__________(填“大于”“小于”或“等于”)0.20mol,理由是___________。
(4)已知![]() 水解可生成亞磷酸
水解可生成亞磷酸![]() 。常溫下,
。常溫下,![]() 溶液的
溶液的![]() ,亞磷酸與足量的NaOH溶液反應生成
,亞磷酸與足量的NaOH溶液反應生成![]() ,則
,則![]() 的
的![]() 溶液中各離子濃度由大到小的順序為_________________。
溶液中各離子濃度由大到小的順序為_________________。
(5)亞磷酸具有強還原性,可被氧化為![]() 。
。![]() 與NaOH溶液反應,反應混合物中含磷各粒子的分布分數(平衡時某粒子的濃度占粒子濃度之和的分數)與pH的關系如圖所示。
與NaOH溶液反應,反應混合物中含磷各粒子的分布分數(平衡時某粒子的濃度占粒子濃度之和的分數)與pH的關系如圖所示。

①為獲得盡可能純的![]() ,pH應控制在_________。
,pH應控制在_________。
②已知:25℃時,![]() 的電離常數為
的電離常數為![]() ,
,![]() ,
,![]() ,則
,則![]() 時,溶液中
時,溶液中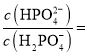 _________。
_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去CuCl2酸性溶液中的FeCl3,加熱攪拌的條件下加入一種試劑,然后再加入適量鹽酸,該試劑不能是( )
A.Cu(OH)2B.CuCO3C.NaOHD.CuO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com