
【題目】在溶液中能大量共存的一組離子是( )
A. K+、H+、SO32-、S2- B. NH4+、K+、OH-、Cl-
C. H+、K+、MnO4-、SO42- D. Fe3+、Na+、S2-、NO3-
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.SiO2溶于水顯酸性
B.SiO2是一種空間立體網狀結構的晶體,熔點高、硬度大
C.光導纖維導電能力很強,是一種很好的通信材料
D.SiO2是一種酸性氧化物,它可以與NaOH溶液反應,但不與任何酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E都是周期表中前四周期的元素,它們的原子序數依次增大。其中A元素原子的核外p電子數比s電子數少1。C是電負性最大的元素。D原子次外層電子數是最外層電子數2倍,E是第Ⅷ族中原子序數最小的元素。
(1)寫出基態C原子的電子排布式_________________。
(2)A、B、C三種元素的第一電離能由大到小的順序為______________(用元素符號表示),原因是___________________。
(3)已知DC4常溫下為氣體,則該物質的晶體類型是_________,組成微粒的中心原子的軌道雜化類型為____________,空間構型是___________。
(4)Cu2+容易與AH3形成配離子[Cu(AH3)4]2+,但AC3不易與Cu2+形成配離子,其原因是______________________。
(5)A、B兩元素分別與D形成的共價鍵中,極性較強的是__________。A、B兩元素間能形成多種二元化合物,其中與A3—互為等電子體的物質的化學式為__________。
(6)已知E單質的晶胞如圖所示,則晶體中E原子的配位數為__________,一個E的晶胞質量為___________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500 mL KNO3和Cu(NO3)2的混合溶液中c(N)= 6.0 mol·L-1,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL,下列說法正確的是( )
A. 原混合溶液中c(K+)為2 mol·L-1
B. 上述電解過程中共轉移2 mol電子
C. 電解得到的Cu的物質的量為0.5 mol
D. 電解后溶液中c(H+)為2 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)與CO互為等電子體的分子和離子分別為______和______。
(2)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
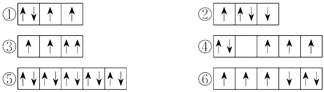
(3)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(4)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知: ①1mol晶體硅中含有2molSi-Si鍵。②Si(s)+O2(g)=SiO2(s)ΔH,其反應過程與能量變化如圖所示。
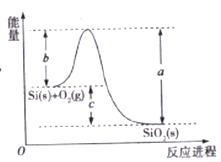
③
化學鍵 | Si-O | O=O | Si-Si |
斷開1mol共價鍵所需能量/KJ | 460 | 500 | 176 |
下列說法正確的是
A. 晶體硅光伏發電是將化學能轉化為電能的
B. 二氧化硅穩定性小于硅的穩定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S的氧化物常會造成一些環境問題,科研工作者正在研究用各種化學方法來消除這些物質對環境的影響。
(1)目前工業上有一種方法是用CO和H2在230℃,催化劑條件下轉化生成甲醇蒸汽和水蒸氣。圖一表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式__________________________________________。
(2)“亞硫酸鹽法”吸收煙氣中的SO2。室溫條件下,將煙氣通入(NH4)2SO3溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖二所示。
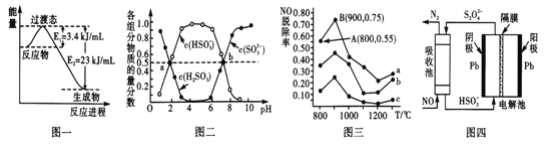
請寫出a點時n(HSO3-):n(H2SO3)=_____,b點時溶液pH=7,則n(NH4+):n(HSO3-)=_____。
(3)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為4NH3+6NO![]() 5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
① 請寫出N2的電子式________。
② 曲線c對應NH3與NO的物質的量之比是______。
③ 曲線a中NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為_____mg/(m3·s)。
(4)間接電化學法可除NO。其原理如圖四所示,寫出電解池陰極的電極反應式(陰極室溶液呈酸性,加入HSO3-,出來S2O42-):____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】VmLAl2(SO4)3溶液中含Al3+ag,取0.2VmL溶液稀釋到5Vml,則稀釋后溶液中SO42-的物質的量濃度是
A. 125a/(9V)mol·L-1 B. 125a/(18V)mol·L-1
C. 20a/(9V)mol·L-1 D. 20a/(18V)mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com