
【題目】膜技術原理在化工生產中有著廣泛的應用。有人設想利用電化學原理制備少量硫酸和綠色硝化劑N205,裝置圖如下,下列說法正確的是( )

A. 圖中B裝置是原電池
B. N2O5在B池的c極區生成,其電極反應式為N2O4+2HNO3-2e-=2N2O5+2H+
C. A裝置中通入O2一極的電極反應式為O2+2H2O+4e-=4OH-
D. 若A裝置中通入SO2的速率為2.24Lmin-1(標準狀況),為穩定持續生產,硫酸溶液的濃度應維持不變,則左側水的流入速率應為14.6mLmin-1
【答案】A
【解析】
A裝置能自發的進行氧化還原反應且沒有外接電源,所以是原電池
B.與電源的正極相連的電極為陽極,c極與正極相連為陽極,N2O4在陽極失電子生成N2O,電極反應式為:2O4+2HNO3-2e2N2O5+2H+2N2O5+2H
C.通入O2一極是原電池的正極,電極反應式為:O2-4e-+4H+=2H2O
D.電池的總反應式為:2Sの2+2H2O+O2=2H2SO4,1mi內2.24Ln(SO2)=0.1mol,消耗水0.1mol
22. 4L/mol生成硫酸的質量為:0.1molx98g/mol=9.8g,消耗水的質量為:0.1molx18g/mol=1.8g,設1min內通入 c mn LH.2O9.8g則有:9.89+z×1g/mL-18。100%=0.5T =11. 6ml/min


科目:高中化學 來源: 題型:
【題目】如圖是元素周期表前四周期的一部分,下列有關R、W、X、 Y、Z五種元素的敘述中,正確的是( )
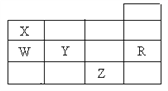
A. 通常情況下五種元素的單質中,Z單質的沸點最高
B. Y、Z的陰離子電子層結構都與R原子的相同
C. W的電負性比X的的電負性大
D. 第一電離能:R>W>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是兩種溶液進行電解的裝置。電極A是由金屬M制成的,M的硝酸鹽的化學式為M(NO3)2,B,C,D都是鉑電極,P,Q是電池的兩極,電路接通后,電極B上金屬有M沉淀出來,

請回答下列問題:
(1)其中P是______極,B是______極。
(2)寫出A極、B極、C極、D極上的電極反應式。
A極上電極反應式為____________________________________________________。
B極上電極反應式為____________________________________________________。
C極上電極反應式為____________________________________________________。
D極上電極反應式為____________________________________________________。
(3)當電路中通過2.4081022個電子時,B極上沉淀出1.28gM,則M的相對原子質量為__________。
(4)如果將電池的正負極交換,接入原電路通過1.2041022個電子時,則 B極上的電極反應式為____________________________________________,A極上析出______ g ______(填物質名稱),甲池的總反應式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于甲、乙、丙、丁四個圖像的說法中,不正確的是( )
 (甲)
(甲)  (乙)
(乙)  (丙)
(丙)  (丁)
(丁)
A. 甲是過量的兩份鋅粉a、b分別加到100mL等濃度的稀硫酸中,同時向a中加入少量CuSO4溶液,產生H2的體積V(L)與時間(min)的關系圖
B. 由乙可知,通電A極上有紅色固體析出,說明鋅的金屬性比銅強
C. 由丙可知,裝置工作一段時間后,a極附近溶液的pH増大
D. 由丁可形成銅鋅原電池,且電路中每轉移2mol電子,在正極會析出64g銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1906年,哈伯在60℃高溫、200兆帕高壓的條件下,用鋨(Os)作催化劑,首次成功得到了氨,但產率較低。隨著科學的進步以及科學家們對催化劑的研究改進,現在工業上普遍采用鐵觸媒(主要成分為Fe3O4,助催化劑:K2O、Al2O3、CaO、MgO、CoO等)做合成氨的催化劑,大大提高了合成氨的產率。回答下列問題:
(1)已知元素Co(鈷)的原子核內有27個質子,則該元素基態原子價電子排布式為___。
(2)元素Fe的基態原子核外未成對電子數為___;Fe2+與Fe3+相比較,___更穩定。
(3)C、N、O處于同一周期,其中第一電離能最大的___,電負性最大的是___,它們與氫形成的簡單氫化物沸點從高到低的順序為___。
(4)NH3分子中N原子的雜化方式為___;氨氣極易溶于水(溶解度1:700),除了氨氣能與水發生反應外,還有兩個原因分別是___、___。
(5)我國長征系列運載火箭使用的液態燃料主要是偏二甲肼[結構簡式:(CH3)2NNH2,可看作是肼(NH2NH2)中同一氮原子上的兩個氫原子被甲基取代]和四氧化二氮,燃燒時發生反應:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2。當該反應消耗1molN2O4時將形成___molπ鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最豐富的元素 |
Y | 植物生長所必需的三種營養元素中,電負性最大的 |
Z | 原子最外層電子數是其電子層數的3倍 |
Q | 其氣態氫化物與其低價氧化物常溫下能反應,生成該元素的單質 |
T | 最高正價與最低負價代數和為6,其單質能與強堿溶液反應制消毒液 |
W | 其+2價陽離子的價電子排布為3d9 |
請回答下列問題:
(1)W元素位于周期表的第___周期___族,W2+能與X、Y形成的簡單分子結合生成一種深藍色的離子,其離子符號為___。
(2)X與Z按原子個數比為1:1組合得到的一種物質甲,它能用于殺菌消毒,物質甲的電子式為___;Q與T也能按原子個數比為1:1組合,得到一種暗黃色的液體乙,其結構與甲相似,則乙中存在的化學鍵類型有___和___;乙遇水發生歧化反應,得到一種淡黃色的固體和兩種具有刺激性氣味的氣體,該反應的化學反應方程式為___。
(3)元素Q的簡單離子半徑___元素T的簡單離子半徑(填“>”“<”或“=”);元素T能形成多種含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由強到弱的順序為___(用化學式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組設計如下微型實驗裝置。實驗時,現斷開K2,閉合K1,兩極均有氣泡產生;一段時間后,斷開K1,閉合K2,發現電流表指針偏轉,下列有關描述正確的是

A. 斷開K2,閉合K1時,總反應的離子方程式為:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 斷開K2,閉合K1時,石墨電極附近溶液變紅
C. 斷開K1,閉合K2時,銅電極上的電極反應為:Cl2+2e—=2Cl—
D. 斷開K1,閉合K2時,石墨電極作正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅鋇白ZnS·BaSO4是一種常用白色顏料,以重晶石(BaSO4)和焦炭粉為原料,在回轉爐中強熱制取可溶性硫化鋇。硫化鋇在凈化后形成溶液,再與硫酸鋅經過一系列過程最終制得鋅鋇白成品。
(1)回轉爐中發生反應的化學方程式為___________________________。
(2)回轉爐尾氣中含有有毒氣體,生產上通入一定量的水蒸氣進行處理,水蒸氣的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”測得。稱取m g樣品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密閉,置暗處反應5 min,有單質硫析出。以淀粉溶液為指示劑,過量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反應式為I2+2S2O32-=2I-+S4O62-。測定時消耗Na2S2O3溶液體積V mL,滴定終點現象為__________,樣品中S2-的含量為____________(寫出表達式與計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,向100mL 0.1mol·L-1 NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH隨NaOH溶液體積的變化如圖所示。下列說法正確的是( )
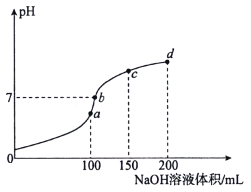
A.圖中a、b、c、d四個點,水的電離程度最大的是d點
B.a點處存在c(NH4+)+c(NH3·H2O)=0.1mol·L-1
C.b點處存在c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.由b到c發生反應的離子方程式為NH4++OH-=NH3·H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com